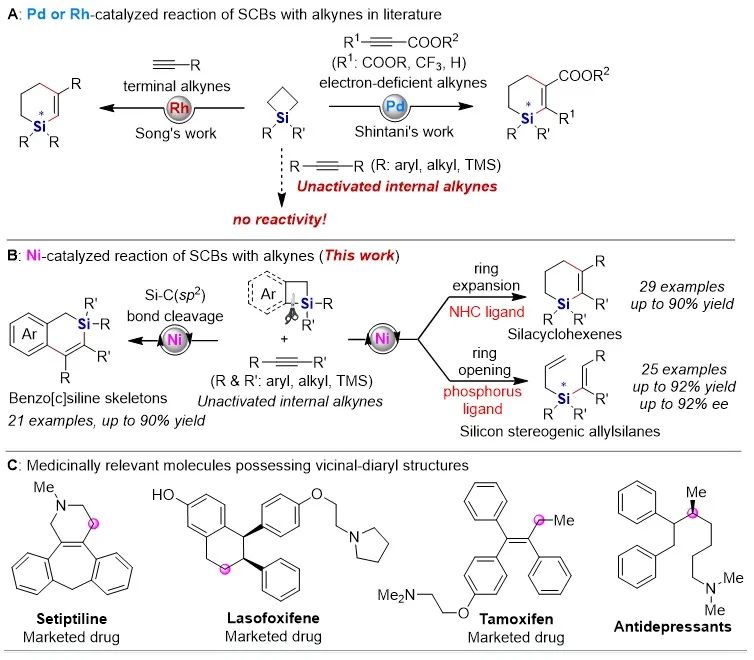
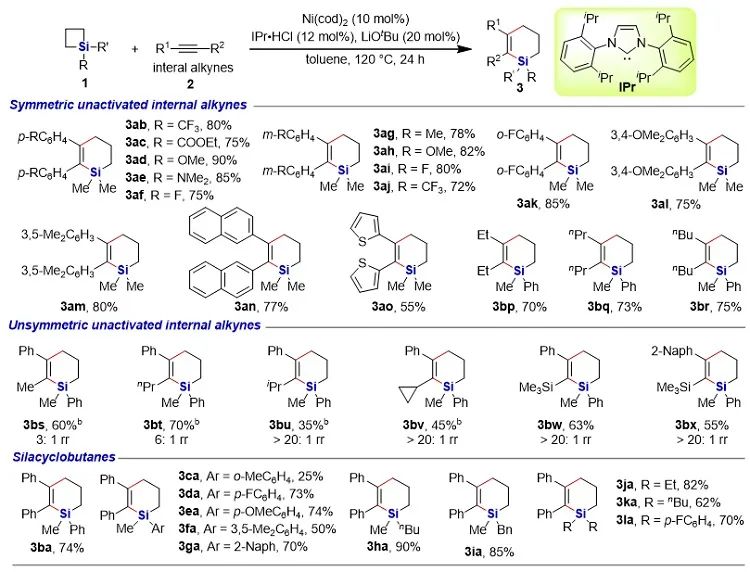
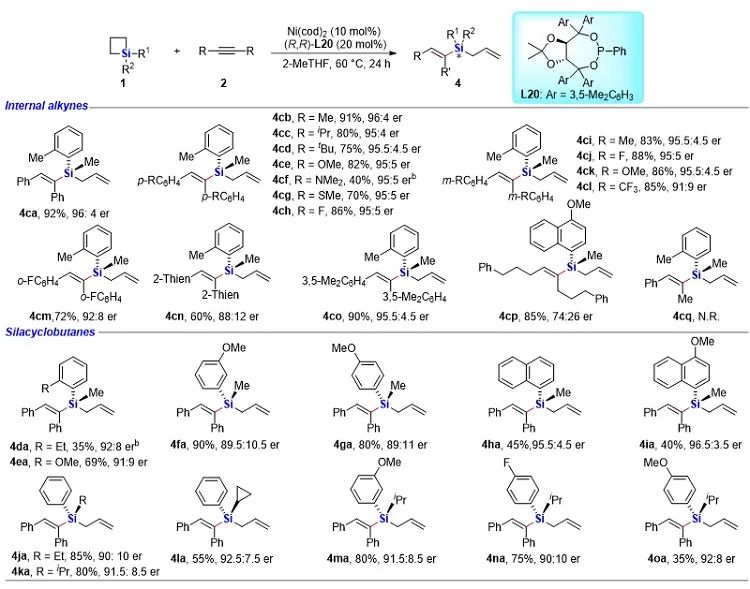
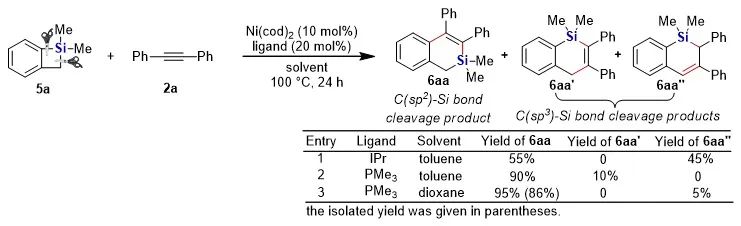
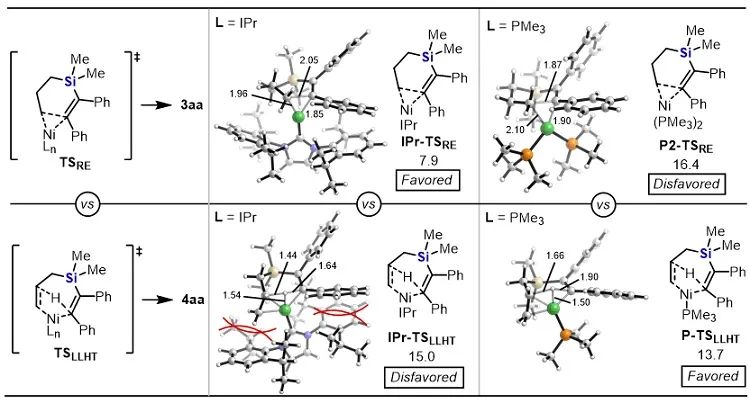
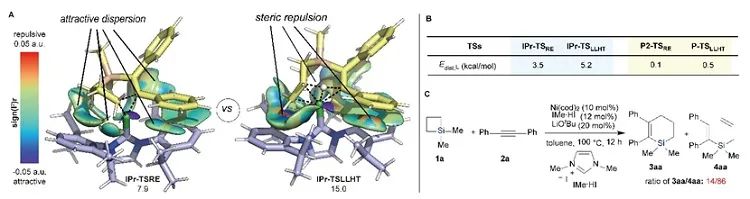
有機硅化合物在有機合成、材料科學、生物醫藥研究中都有著廣泛的應用,開發新的硅基合成子以及發展綠色高效的合成方法對推動有機硅化學的發展具有重要意義。近年來,硅雜環丁烷 (SCB) 作為合成子引起了廣泛關注,被應用于許多有機硅化合物的高效合成。其中過渡金屬催化下SCB與炔烴的環加成反應是最活躍的研究方向之一,并且取得了一定的進展,但仍然存在三個方面的局限性(圖1A):(1) 反應主要使用鈀或者銠等貴金屬催化劑;(2) 活性較低的非活化內炔與SCB的反應尚未有報道;(3) 不對稱反應中對映選擇性控制還有提升空間。近日,南開大學趙東兵課題組通過鎳催化實現了非活化內炔與(苯并)硅雜環丁烷之間的反應,并且通過不同的配體實現了反應化學選擇性、區域選擇性以及對映選擇性的精準調控(圖1B)。圖1. 硅雜環丁烷與炔烴的反應現狀以及鄰二芳基骨架在藥物中的應用作者首先利用硅雜環丁烷與二苯乙炔作為模板底物進行了條件篩選。他們發現,在10 mol% Ni(cod)2及12 mol% IPr的作用下,利用甲苯作溶劑時,在120 ℃條件下,環加成反應能夠順利進行,并以84%的分離收率得到單一產物硅雜環己烯。該催化體系具有良好的底物普適性(圖2),無論是對稱的二芳基炔烴還是二烷基炔烴都能兼容,以中等至較高的收率得到硅雜環己烯衍生物。不對稱的內炔如1-苯基-1-烷基炔以及1-芳基2-三甲硅基炔烴與硅雜環丁烷的環加成反應也能夠順利進行,并以中等的收率和中等至優異的區域選擇性形成環加成產物。與之對應的是,作者發現,當使用三甲基膦作配體時,硅雜環丁烷與二苯乙炔反應生成開環產物烯基硅烯。隨后作者通過大量的手性配體篩選,發現使用Taddol衍生的手性亞磷酸酯配體可以實現開環反應的化學選擇性和立體選擇性控制,最終以優異的對映選擇性得到了具有硅手性中心的烯基硅烷衍生物(圖3)。在最優反應條件下,作者對內炔底物的適用性進行了考察,結果表明1,2-二芳基乙炔底物能夠很好的兼容,無論芳環上含有吸電子取代基還是供電子取代基,大部分反應都可以順利進行并且以中等至良好的產率 (40-92%) 和優異的對映選擇性(up to 96:4 er)生成目標產物。1,2-二烷基炔烴與硅雜環丁烷的不對稱開環反應雖然也能順利進行,但是反應對映選擇性降低較為明顯。催化體系對于不對稱的1-苯基-1-烷基炔烴不能適用。該不對稱催化體系對于硅基上帶有不同位阻和電子效應的硅雜環丁烷底物也能夠很好的適用。與硅雜環丁烷相比,苯并硅雜環丁烷結構中同時含有C(sp2)-Si鍵和C(sp3)-Si鍵,苯并硅雜環丁烷與炔烴的反應往往遭遇區域選擇性問題。本文中,作者通過對配體和溶劑的篩選,最終在小位阻的三甲基膦配體的條件下,以高的區域選擇性得到選擇性斷裂苯并硅雜環丁烷C(sp2)-Si鍵的產物6aa。催化體系同樣適用于二芳基炔、二烷基炔以及不對稱內炔底物(圖4)。在完成底物擴展之后, 作者分別對硅雜環己烯產物和手性烯基硅烷產物進行了一系列的衍生化反應。隨后,作者對不同配體控制的SCB與炔之間的發散性反應的根源通過DFT計算以及一系列控制實現進行了研究(圖5),結果顯示,當合用IPr作為配體時,中間體傾向于發生還原消除,而使用小位阻的磷配體時,中間體則傾向于發生LLHT過程,從而生成開環產物。最后,對其關鍵中間體進行了可視化分析,認為不同配體條件下硅雜環丁烷與內炔反應的化學選擇性主要來源于配體的位阻影響。 綜上所述,趙東兵課題組開發了以廉價金屬鎳為核心的催化劑,通過配體的調控實現了硅雜環丁烷與非活化內炔分子間的化學選擇性的環加成反應和對映選擇性的開環反應,以及內炔對苯并硅雜環丁烷 C(sp2)-Si 鍵高度選擇性的插入反應等三類新反應,合成出多個系列硅雜環己烯衍生物和具有硅手性中心的烯基硅衍生物。另外對產物進行了一系列的衍生化反應,并且通過密度泛函理論計算對不同配體下化學選擇性差異的原因提出了合理解釋。該研究成果近期發表在Nature Communications 上,論文通訊作者為南開大學趙東兵研究員,第一作者為博士研究生王希超,李勃和鞠成威對本文的計算和實驗做了重要貢獻。該項研究得到了國家自然科學基金面上項目以及國家自然科學優秀青年基金的支持。
原文
Nickel(0)-catalyzed divergent reactions of silacyclobutanes with internal alkynes
Xi-Chao Wang, Bo Li, Cheng-Wei Ju & Dongbing Zhao
Nat. Commun., 2022, 13, 3392, DOI: 10.1038/s41467-022-31006-y
參考資料:https://chem.nankai.edu.cn/2022/0630/c24075a460600/page.htm