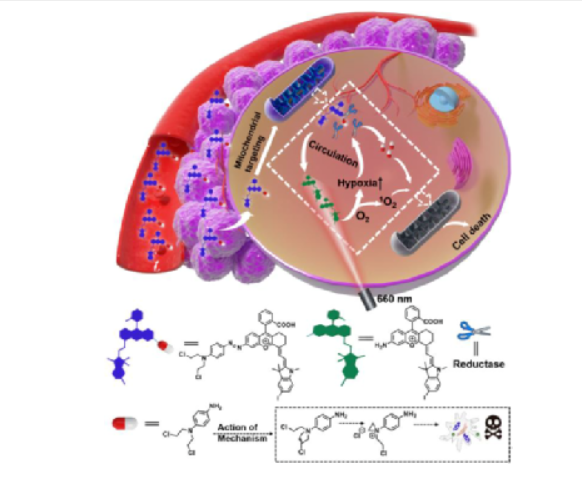
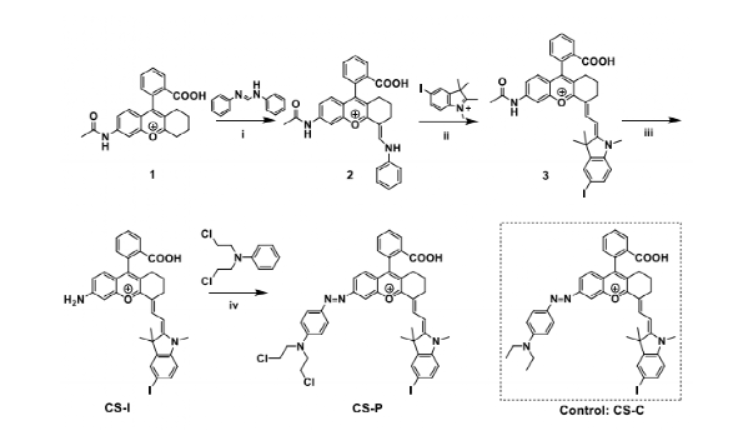
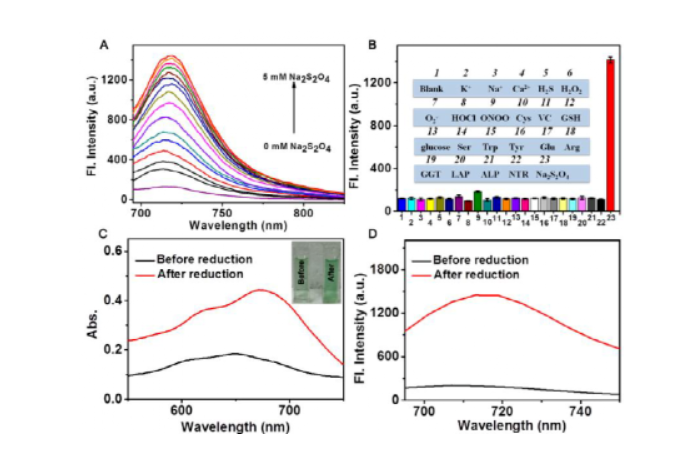
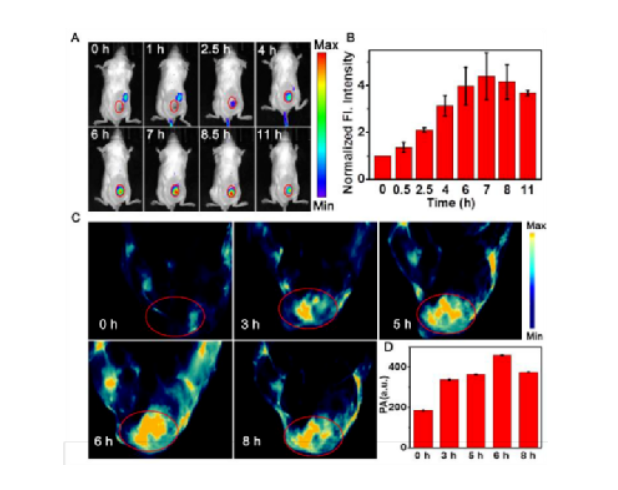
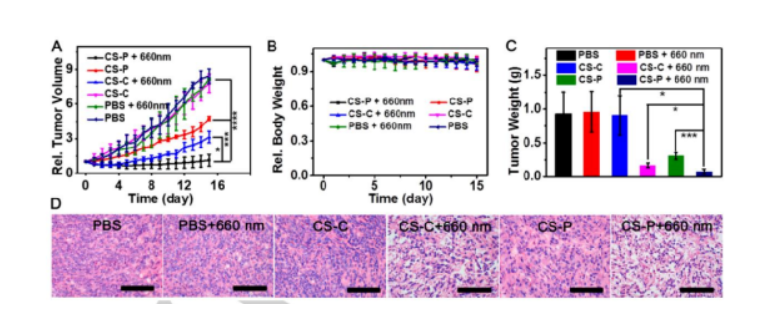
缺氧是腫瘤微環(huán)境的重要特征,在化療前藥的設(shè)計(jì)中已經(jīng)成為重要的靶點(diǎn),以降低傳統(tǒng)化療藥物的副作用。但是,由于腫瘤間缺氧水平分布不均,缺氧激活前藥的釋放效率通常受到缺氧程度的限制,從而導(dǎo)致治療效果不理想。另一方面,光動(dòng)力療法(PDT)作為一種很有前途的癌癥治療方法一直受到廣泛關(guān)注,其作用機(jī)制涉及消耗細(xì)胞內(nèi)的氧氣產(chǎn)生有毒的單線態(tài)氧來殺死細(xì)胞,從而加劇細(xì)胞缺氧程度。因此,在一定程度上,光動(dòng)力療法可用于促進(jìn)缺氧活化前藥的釋放,并且化療和PDT結(jié)合可以有效提高治療的效率。基于這種設(shè)計(jì)理念,作者將缺氧激活的前藥與近紅外光敏劑相結(jié)合設(shè)計(jì)并合成了一種線粒體靶向分子前藥CS-P。圖 1. 分子前藥的結(jié)構(gòu)及作用示意圖(圖片來源:Angew. Chem. Int. Ed.)在該設(shè)計(jì)策略中,作者選擇偶氮基團(tuán)用于連接化療藥物和光敏劑,其既可以作為熒光淬滅劑又是抗癌藥物的滅活劑。在腫瘤的缺氧微環(huán)境中,偶氮鍵可以被還原以釋放出治療藥物和光敏劑,并且伴隨近紅外熒光和光聲信號(hào)的變化,可以通過雙模成像準(zhǔn)確監(jiān)測化療藥物的釋放。重要的是,釋放的光敏劑在660 nm激光照射下可以通過PDT過程消耗腫瘤內(nèi)氧氣,增加腫瘤缺氧程度,從而進(jìn)一步誘導(dǎo)更大程度的抗癌藥物釋放。圖 2. 分子前藥的合成(圖片來源:Angew. Chem. Int. Ed.)首先,作者在體外研究了CS-P釋放藥物的可行性以及相應(yīng)的光學(xué)變化。在加入連二亞硫酸鈉(Na2S2O4,偶氮還原酶的化學(xué)模擬物)后,由于偶氮鍵的斷裂,前藥分子在680 nm處的吸收強(qiáng)度顯著提升,并且716 nm處的熒光得到了14倍的增強(qiáng)。接著,為了驗(yàn)證CS-P對(duì)缺氧的特異性響應(yīng),作者測試了CS-P對(duì)其他分析物(如陽離子、生物活性分子和腫瘤過表達(dá)酶)的反應(yīng)。結(jié)果顯示,CS-P僅在Na2S2O4存在下表現(xiàn)出顯著的熒光增強(qiáng),表明了其在治療缺氧腫瘤中的高選擇性和潛在應(yīng)用。此外,在含有偶氮還原酶的大鼠肝微粒體體系中也觀察到了同樣的光學(xué)變化,證明了在缺氧條件下,前藥可被偶氮還原酶還原以釋放化療藥物,而且可以通過雙模成像準(zhǔn)確跟蹤藥物釋放。圖 3. 分子前藥的光物理性質(zhì)(圖片來源:Angew. Chem. Int. Ed.)接著,作者通過共聚焦熒光成像在細(xì)胞水平驗(yàn)證了分子前藥在缺氧環(huán)境中釋放藥物的能力,并且對(duì)激活前后的光動(dòng)力能力進(jìn)行了評(píng)估,證明了缺氧反應(yīng)后的前藥在光照下可以產(chǎn)生1O2。體內(nèi)熒光成像和光聲成像實(shí)驗(yàn)中,在靜脈注射后7~8 h后,熒光和光聲信號(hào)達(dá)到最大值,表明該時(shí)間點(diǎn)前藥反應(yīng)達(dá)到飽和,化療藥物和光敏劑的釋放達(dá)到最大值,進(jìn)而可以進(jìn)行光照以加劇腫瘤的缺氧,同時(shí)促進(jìn)藥物更快更有效的釋放。后續(xù)實(shí)驗(yàn)中,光照組腫瘤部位的熒光強(qiáng)度在初始降低后呈上升趨勢,從而證明PDT促進(jìn)了藥物的釋放。圖 4. 分子前藥的體內(nèi)熒光和光聲成像(圖片來源:Angew. Chem. Int. Ed.)此外,該前藥分子可以很好地靶向線粒體并通過破壞線粒體誘導(dǎo)細(xì)胞死亡。治療結(jié)果表明,前藥分子的治療效果隨著PDT過程的加入而顯著提高,實(shí)現(xiàn)了顯著提升的藥物釋放效率和協(xié)同治療效果,并且對(duì)正常組織無明顯毒性,表明其在癌癥治療中的潛在應(yīng)用。圖 5. 腫瘤治療效果(圖片來源:Angew. Chem. Int. Ed.)總結(jié):湖南大學(xué)袁林、張曉兵團(tuán)隊(duì)報(bào)道了一種通過光動(dòng)力療法提高分子化療前藥釋放效率的設(shè)計(jì)策略。實(shí)驗(yàn)結(jié)果表明,該分子前藥可以在缺氧腫瘤中被選擇性激活,同時(shí)釋放化療藥物和光敏劑,并且通過熒光和光聲成像可以實(shí)時(shí)監(jiān)控釋放過程。重要的是,在光照條件下,CS-P的活化可以進(jìn)一步增強(qiáng),釋放出更多的化療藥物和光敏劑。此外,CS-P可以靶向線粒體并通過破壞線粒體來誘導(dǎo)細(xì)胞死亡。體內(nèi)實(shí)驗(yàn)結(jié)果表明,PDT輔助藥物釋放策略對(duì)腫瘤生長有較好的抑制作用。該工作為不同治療方法的有效組合提供了新途徑,并為增強(qiáng)缺氧激活前藥的釋放提供了新思路。Yuan, J., Zhou, Q., Xu, S., Zuo, Q., Li, W., Zhang, X., Ren, T., Yuan, L. and Zhang, X. (2022), Enhancing the Release Efficiency of Molecular Chemotherapeutic Prodrug by Photodynamic Therapy. Angew. Chem. Int. Ed.. https://doi.org/10.1002/anie.202206169