- 首頁
- 資訊
Nat. Commun.劉聰合作團(tuán)隊(duì)闡釋漸凍人癥關(guān)鍵致病蛋白SOD1淀粉樣聚集的分子機(jī)制
來源:中國科學(xué)院生物與化學(xué)交叉研究中心 2022-06-28
導(dǎo)讀:肌萎縮側(cè)索硬化癥(Amyotrophic lateral sclerosis, ALS)又稱漸凍人癥,是一類嚴(yán)重危害人類健康且目前無藥可醫(yī)的神經(jīng)退行性疾病。每年的6月21日被定為 “全球漸凍人日”。
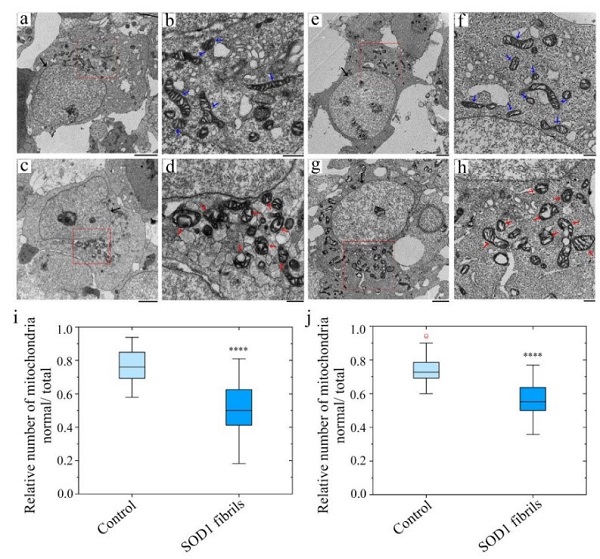
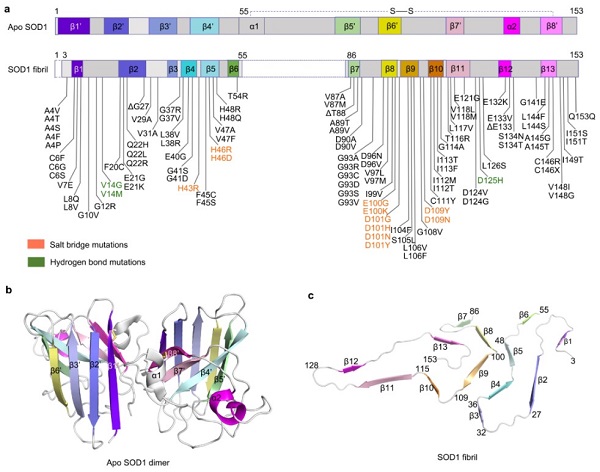
ALS的一個(gè)重要病理特征是包括SOD1,F(xiàn)US,以及TDP-43在內(nèi)的多種致病蛋白在中樞神經(jīng)系統(tǒng)的運(yùn)動(dòng)神經(jīng)元中聚集形成淀粉樣纖維沉積,蛋白聚集的形成與ALS疾病的發(fā)生發(fā)展密切相關(guān)。上海有機(jī)所交叉中心劉聰課題組長期聚焦ALS關(guān)鍵致病蛋白異常相變及淀粉樣聚集的分子機(jī)制及化學(xué)干預(yù)研究。前期系統(tǒng)研究揭示包括TDP-43及FUS在內(nèi)的多個(gè)ALS致病蛋白相變調(diào)控紊亂的內(nèi)在機(jī)制及在ALS中的致病作用,為理解不同蛋白病理聚集在ALS中的致病作用提供了基礎(chǔ)。近日,劉聰課題組與武漢大學(xué)梁毅課題組合作在Nature Communications在線發(fā)表題為“Cryo-EM structure of an amyloid fibril formed by full-length human SOD1 reveals its conformational conversion”的研究成果。在這項(xiàng)研究中,研究人員聚焦ALS的病理蛋白SOD1,通過體外重構(gòu)的方式模擬其病理聚集過程,并運(yùn)用冷凍電鏡解析其形成病理淀粉樣纖維的原子結(jié)構(gòu),發(fā)現(xiàn)了一類全新的病理纖維結(jié)構(gòu)排列模式。相應(yīng)工作揭示了SOD1通過構(gòu)象變化形成病理纖維聚集的結(jié)構(gòu)基礎(chǔ),為深入理解多個(gè)重要ALS家族性突變加速疾病進(jìn)程提供了新的研究思路和視角。SOD1是真核細(xì)胞抵抗活性氧(ROS)的抗氧化應(yīng)激酶系中的重要成員,其主要位于細(xì)胞質(zhì)中。在目前眾多的已知ALS致病蛋白中,SOD1是最早在家族型遺傳ALS中被鑒定出來的。在針對ALS的長期基礎(chǔ)及臨床研究中,SOD1一直備受關(guān)注。然而,對于其在病理?xiàng)l件下,如何通過構(gòu)象變化與自組裝從天然生理活性構(gòu)象轉(zhuǎn)變?yōu)椴±砭奂瘶?gòu)象?在本領(lǐng)域內(nèi)一直是一個(gè)懸而未決的關(guān)鍵科學(xué)問題。在本工作中,研究人員首先體外通過自聚集實(shí)驗(yàn)重構(gòu)了具有高度均一性的人源SOD1淀粉樣纖維,并發(fā)現(xiàn)體外制備的淀粉樣纖維具有顯著的細(xì)胞毒性,并能有效誘導(dǎo)細(xì)胞內(nèi)線粒體形態(tài)及功能的紊亂(圖1)。進(jìn)一步,研究人員運(yùn)用冷凍電鏡技術(shù)在原子水平解析了SOD1淀粉樣纖維高分辨率原子結(jié)構(gòu)(2.95 ?),發(fā)現(xiàn)SOD1纖維由單股原纖維以左手螺旋的方式纏繞而成。纖維核心由其N端的3-55區(qū)域和C端的86-153區(qū)域組成,這兩個(gè)區(qū)域通過Lys36和Asp109之間,His43和Asp101之間以及His46和Glu100之間形成的3對鹽橋緊密結(jié)合在一起。另外,纖維核心的疏水氨基酸側(cè)鏈向內(nèi)折疊形成5個(gè)疏水空腔,起到了穩(wěn)定淀粉樣纖維結(jié)構(gòu)的作用。更為重要的是,在SOD1纖維結(jié)構(gòu)中構(gòu)成鹽橋的五個(gè)關(guān)鍵氨基酸殘基(包括: His43、His46、Glu100、Asp101和Asp109)均為ALS家族遺傳的病理突變位點(diǎn)(圖2)。因此本研究為理解家族遺傳突變調(diào)控SOD1蛋白病理聚集提供了新的思路。圖2:SOD1中ALS家族突變在病理纖維及天然構(gòu)象中的分布綜上,本研究在原子水平上首次揭示了SOD1由生理天然構(gòu)象向病理聚集結(jié)構(gòu)轉(zhuǎn)變的機(jī)制,暗示不同ALS疾病突變體在調(diào)節(jié)SOD1構(gòu)象轉(zhuǎn)化中的重要潛在作用,為基于SOD1病理淀粉樣聚集結(jié)構(gòu)的ALS藥物研發(fā)提供了基礎(chǔ)。論文鏈接:https://www.nature.com/articles/s41467-022-31240-4
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn