

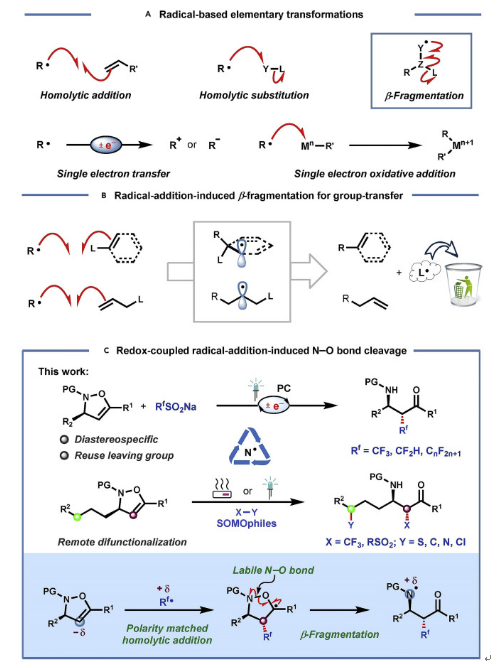
圖1. 自由基反應的種類和本文工作的介紹(圖片來源:Chem)
在一定的條件下,利用單電子轉移SET的方式斷裂N-O鍵能容易的產生相應的自由基,主要歸功于斷裂N-O共價鍵只需要較低的鍵裂解能,同時該反應會釋放出一些小分子片段來驅動該反應的快速進行,這一方面Leonori和Studer等人做了非常突出的工作(Angew. Chem. Int. Ed. 2018, 57, 10707-10711; Angew. Chem. Int. Ed. 2017, 56, 12273-12276;)。通過SET途徑來獲取自由基并應用于反應過程需要浪費一部分離去基團,原子經濟性較差(圖1B)。在這種情況下,自由基加成誘導的N-O鍵β-裂解在原體系生成自由基的同時將產生的自由基片段應用于后續串聯反應,這樣提高和豐富了這類反應的轉化。基于課題組工作基礎上(Angew. Chem. Int. Ed. 2017, 56, 14918-14922; Nat. Comm. 2015, 6, 7472;),南京工業大學馮超課題組報道了利用自由基加成誘導β-裂解的策略對4-異噁唑啉衍生物進行了開環官能團化研究。這項工作的突出特點包括:1)利用4-異噁唑啉衍生物作為有效的親核SOMO體,并且能完成后續的開環轉化;2)該策略可以溫和高效的生成高價值的α-三氟甲基-β-氨基酮分子骨架;3)通過熱誘導選擇性的原子轉移,N-O鍵β-裂解的開環產物可以和不同的親電體實現開環遠程雙官能團化反應,豐富了該類反應的轉化;4)使用容易獲得的手性4-異噁唑啉也可以很容易獲得高對映性的產物(圖1C)。文章鏈接DOI:10.1016/j.chempr.2022.05.014
研究反應條件的探索
反應最初的研究是集中在光氧化還原條件下3,5-二苯基異噁唑1a'與Langlois試劑2a的開環三氟甲基化;然而,該反應無法得到所需的α-三氟甲基-β-二酮3a'。作者推測這種反應失敗的主要原因是由于CF3自由基和芳香族之間的極性不匹配的緣故,這樣會導致自由基加成步驟行不通而后也阻礙了后續的開環反應。作者將芳香環體系的異噁唑啉1a'改為非芳香族二氫異噁唑啉衍生物1a,這樣就可以解決CF3自由基不能加成到芳香化合物的問題(圖2)。
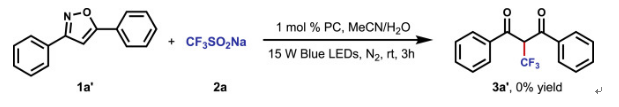
圖2. 最初反應設想的探索(圖片來源:Chem)
反應以二氫異噁唑啉衍生物1a作為三氟甲基自由基的接受體,當使用[Ir(ppy)2(dtbbpy)](PF6) (E1/2ox= +1.05 V vs SCE)作為光催化劑,藍燈光照3小時可以以核磁收率5%得到開環產物3a,產物3a以單一的非對映體形式形成,這說明了新形成的三級碳的立體構型是受相鄰立體中心的控制。隨后通過系統的條件篩選發現以[Ir(dF(CF3)ppy)2(4,4′-dCF3bpy)]PF6 (E1/2ox= +1.65 V vs SCE)作為催化劑,可以得到87%的產物3a。添加水有利于反應結果,這可能是水有助于提高2a的溶解度。控制實驗表明,光照射和光催化劑的存在對于這種轉化的成功至關重要(圖3)。
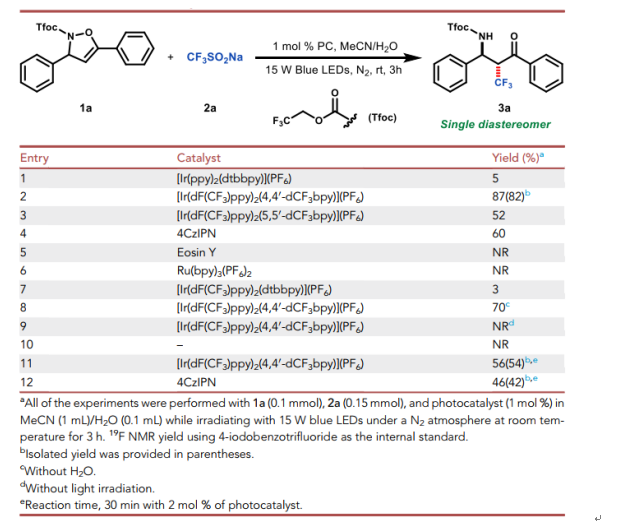
圖3. 實驗條件的篩選和優化(圖片來源:Chem)
底物范圍
在得到了最優條件之后,作者對于底物范圍進行了考察。當C-5位的芳基上無論是缺電子還是給電子取代基,反應都具有良好的耐受性(3a-3g)。同時,R1取代基即可以是芳基,也可以是脂肪族取代基,它們都可以順利地參與該反應,并以良好至優異的產率得到所需的產物(3h-3m)。以化合物1i作為該反應的底物,其C-5位包含一個環丙基,該反應也能夠順利進行,以90%的收率得到所需的產物3i,沒有觀察到環丙基開環副產物。其它的芳基取代基也能夠與該反應兼容,在用萘基取代的1t作為該反應的底物時,以中等收率得到產物3t。含有雜環的4-異噁唑啉衍生物也具有良好的相容性(3u-3x)。除了能在反應中引入三氟甲基基團,其他的氟代試劑也可以應用于體系中,該反應可以很容易地獲得一系列α-全氟烷基-β-氨基酮衍生物(3af-3am)。作者還對N-保護基進行了繼續研究。當2,2,2-三氟乙氧基羰基(Tfoc)基團被Troc基團取代時,反應收率顯著下降(3an)。進一步的研究表明,芐氧基羰基(Cbz)也適合這種轉化,該過程可以以70%的收率得到所需的產物3ao,但其他保護基團如叔丁氧羰基(Boc)不太適合這種轉化,以相對較低的產率得到產物3ap。底物如果采用苯甲酰基保護基,反應也可以55%的收率分離產物3aq。值得注意的是,當C-4位上含有取代基的時,反應不能得到所需產物(3as和3at)。在整個轉化的過程中,都是以高度非對映選擇性的方式進行的,這些結果表明均裂加成的方向完全由C-3位上的取代基控制,來消除空間上的排斥(圖4)。
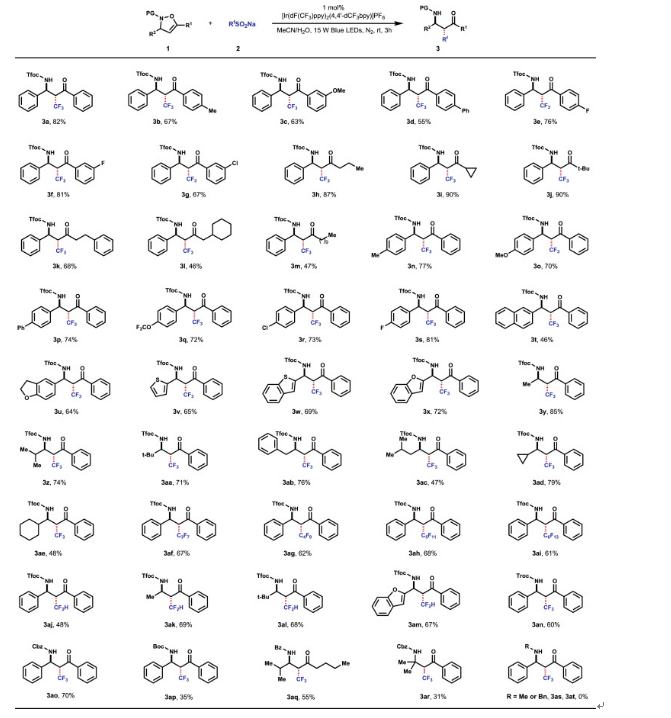
圖4. 實驗底物范圍的探索(圖片來源:Chem)
自由基加成誘導的β-斷裂和后續的遠程C-H功能化的研究
在做完上述反應的研究之后,作者試想是否有可能利用新生的以氮為中心的自由基進行進一步的反應研究,這樣就可以實現遠程的雙官能團化反應,這樣的例子在文獻當中極少報道。當使用PhSO2SCF3作為自由基接受體,在相同的光氧化還原催化環境下,以二氫4-異噁唑啉衍生物4m作為模板底物,該反應可以以高產率得到三氟甲硫基磺化產物5m。光催化劑篩選表明,2CzIPN(E1/2ox= +1.36 V vs SCE)做反應體系的光催化劑時,反應可以在30分鐘內以82%的分離產率得到所需的產物,同時進一步的控制實驗證明了光催化劑在該反應中的必要性(圖5)。

圖5. 遠程雙官能團化反應的探索(圖片來源:Chem)
遠程的官能團化反應的底物范圍
利用該上述優化的實驗條件,作者對反應物的底物范圍也進行了相關考察。實驗發現C-3位烷基取代基種類在反應中具有良好的兼容性,實驗都以良好至高產率獲得了相應的α-磺酰基-β-氨基酮衍生物(5a-5l)。環狀底物(5d-5f),氯化物(5h)和醚(5i)都能夠適用于該反應。在C-5位上具有(雜)芳基、烯基和烷基的底物也是可行的,以高產率和中等至優異的非對映選擇性(5m-5w)得到所需的產物。芳環上的鹵原子(F或Cl)取代基(5l-5q)和烷基取代基(5v)的醚基對反應效率影響不大。值得注意的是,具有大位阻的甲硅烷基取代基的底物(5x)也可以以高度非對映選擇性順利進行。此外,通過改變自由基接受體的結構,反應還可以很容易地引入其它合成有用的官能團,包括硫醚(5ac )、烯丙基( 5ad )、氰基( 5ae )、二硫烷基( 5af )、疊氮化物( 5ag )、炔烴( 5ah )和氯化物( 5ai ),這些轉化展示了該反應的實用性和多樣性(圖6)。
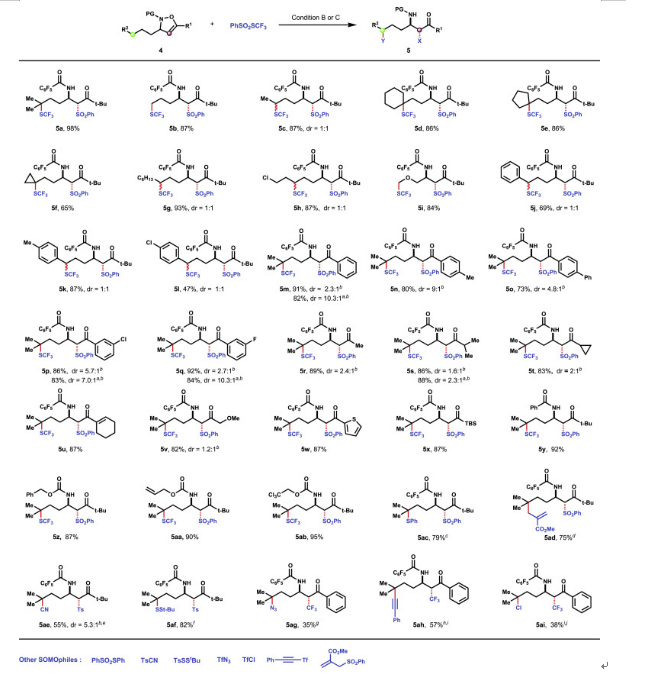
圖6. 遠程官能團化反應的底物類型(圖片來源:Chem)
其它多組分反應
除了原子轉移反應外,移位的自由基中間體還可以用于參與其它類型的反應。例如,使用2-亞芐基丙二腈作為親核自由基受體,該三組分反應在光氧化還原條件下也可以以35%的產率得到6a。此外,當分別使用Togni試劑和TMSN3作為自由基前體和疊氮化物源時,三組分遠程三氟甲基化-疊氮化反應在鐵催化下也可以順利完成(圖7)。
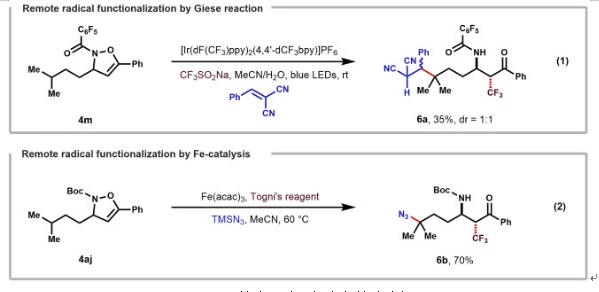
圖7. 其它三組分反應的實例(圖片來源:Chem)
底物的合成轉化和應用
同樣地,作者還進行了α-三氟甲基-β-酮產物的衍生化實驗。例如,以鈀作為催化劑的條件下,3a會與苯硼酸進行脫氟芳基化反應,以77%的收率得到四取代的氟代烯烴產物7a。酮官能團也可以順利進行氫化還原或格氏反應。此外,當對3a進行鈀催化的烯丙基烷基化反應時,可以56%的收率順利獲得了含全碳季碳中心的產物7c(圖8)。
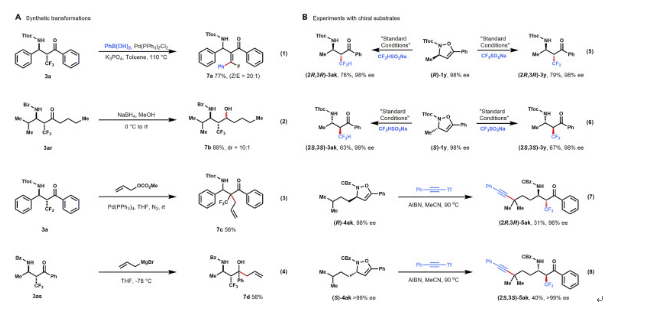
圖8. 底物的合成轉化和應用實驗(圖片來源:Chem)
為了進一步展示這種轉化的優勢,作者還探索了(R)-和(S)-1y和4ak的轉化。使用(R)和(S)-1y作為反應底物,可以以良好的收率和高對映純度得到3y和3ak的兩種對映體,同時,從(R)和(S)-4ak和5ak的兩種對映異構體在以AIBN作為自由基引發劑時,以炔基化的對映異構體為產物的轉化能夠順利進行,同時該反應的立體選擇性能夠得到高度的保持(圖8B)。
為了更詳細地了解該反應的機理,作者還進行了自由基對照實驗:產物3a的形成在TEMPO存在下會被抑制。當使用自由基鐘作為反應底物時,能夠觀察到開環產物的存在,這也證實了移位碳自由基中間體的存在。此外,Stern-Volmer熒光淬滅實驗清楚地表明激發態Ir(III)會被Langlois試劑2a淬滅。此外,量子產率1a和4p的反應率分別為1.6和 1.89,這表明該反應過程是鏈式反應。
總結
馮超課題組報道了利用自由基加成誘導β-裂解的策略對4-異噁唑啉衍生物進行了開環官能團化,這一策略可以直接高效合成α-三氟甲基-β-氨基酮衍生物。實驗通過進一步利用以氮為中心的自由基中間體發生的1,5-HAT和后續遠程官能團化實現了開環遠程官能團化,該轉化具有原子經濟性高、反應條件溫和、底物適用范圍廣和區域選擇性高等優異特性。
參考資料:https://mp.weixin.qq.com/s/zoYf0RTdFLURi-zIgWgABQ
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn