

(圖片來源:Angew. Chem. Int. Ed.)
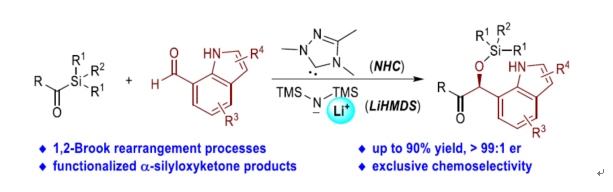
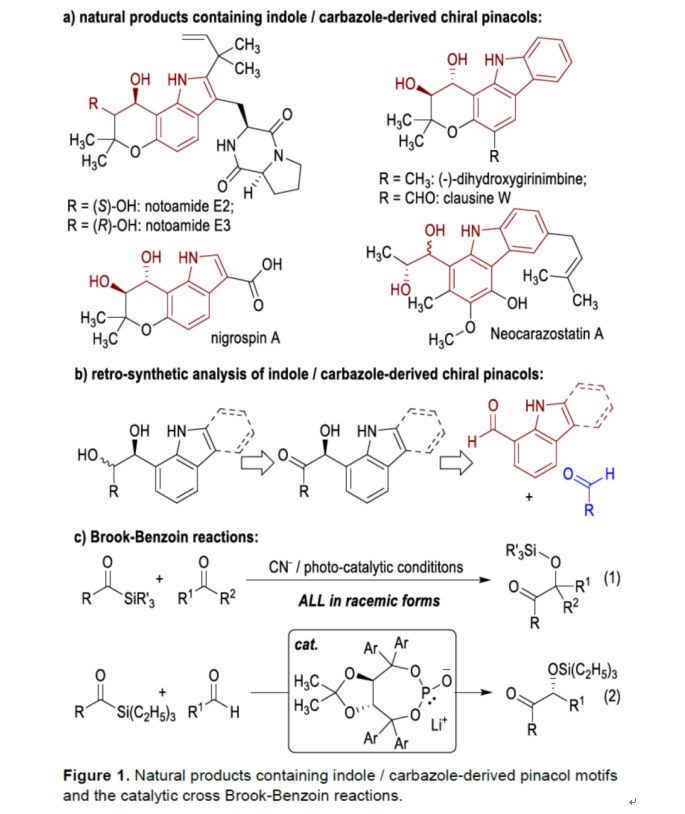
手性吲哚和咔唑分子廣泛存在于天然產物中,并具有潛在的生物活性。其中,衍生自吲哚和咔唑基的手性頻哪醇分子在藥物的開發中具有重要的意義,如Notoamides E2/E3、Nigrospin A、Neocarazostatin A等(Figure 1a)。因此,開發用于構建吲哚和咔唑衍生的手性頻哪醇分子的高效和對映選擇性策略具有重要的意義。通過逆合成分析發現,含有雜芳基生物堿的手性α-羥基酮是反應的關鍵前體(Figure 1b)。合成α-羥基酮分子的最直接方法可能是安息香反應。然而,在使用兩種不同的醛(或醛和酮)為底物的經典安息香反應中,反應的化學選擇性極具挑戰。其中,使用酰基硅烷代替其中一種醛底物的Brook-Benzoin反應是一種解決化學選擇性問題的策略(Figure 1c)。同時,金屬氰化物和Lewis酸是該轉化的催化劑(Figure 1c, eq. 1)。然而,大多數Brook-Benzoin反應均以外消旋形式進行。2004年,Johnson課題組報道了一種使用手性金屬亞磷酸酯(metallophosphite)作為催化劑實現了對映選擇性交叉 Brook-Benzoin反應(Figure 1c, eq. 2)。然而,對于NHCs或其它有機催化劑催化的對映選擇性Brook-Benzoin反應,仍有待進一步的探索。并且,該反應存在兩個主要的挑戰:(1)空間位阻阻礙了手性NHC催化劑與酰基硅烷底物的加成;(2)NHCs催化劑在酰基硅烷與醛親電試劑的化學選擇性問題。
(圖片來源:Angew. Chem. Int. Ed.)
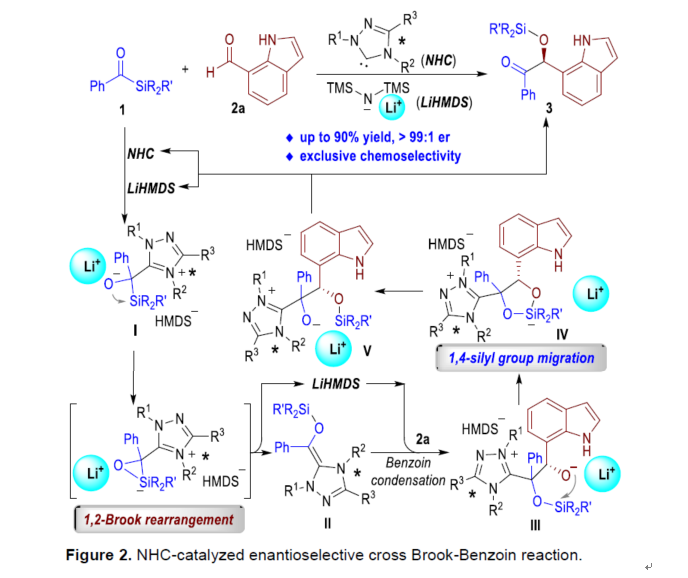
近日,貴州大學金智超、郝格非和池永貴團隊報道了首例卡賓催化酰基硅烷和醛的不對稱交叉Brook-Benzoin反應(Figure 2)。首先,手性NHC催化劑可進攻酰基硅烷1生成兩性離子中間體I,經LiHMDS促進的1,2-Brook重排生成硅基化Breslow中間體II。為了避免醛底物和NHC催化劑的競爭性副反應,使用含有較少親電羰基碳的吲哚醛2a與Breslow中間體II進行Benzoin縮合反應,生成兩性離子中間體III。在LiHMDS協助下,通過1,4-硅基遷移反應可獲得中間體V,涉及五元環中間體IV的形成。最后,中間體V消除NHC催化劑和LiHMDS后,可獲得目標產物3。
(圖片來源:Angew. Chem. Int. Ed.)
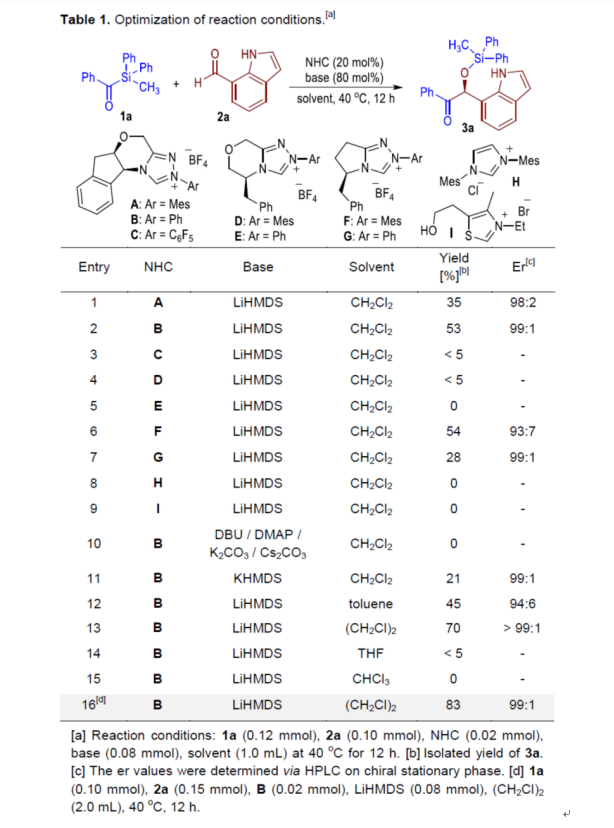
首先,作者以苯甲酰基硅烷1a與吲哚醛2a作為模型底物,進行了相關不對稱Brook-Benzoin反應條件的篩選(Table 1)。當以B作為NHC催化劑,LiHMDS作為堿,在(CH2Cl)2溶劑中反應,可以83%的收率得到產物3a,er為99:1。
(圖片來源:Angew. Chem. Int. Ed.)
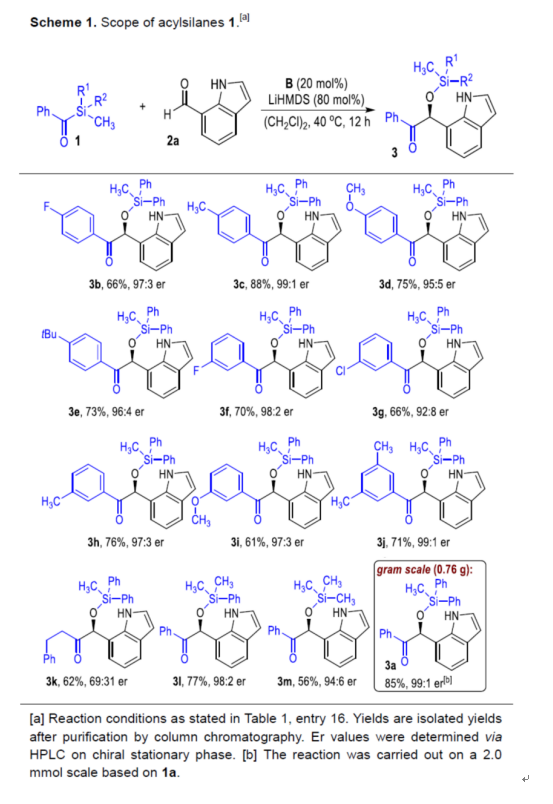
在獲得上述最佳反應條件后,作者首先對酰基硅烷底物1的范圍進行了擴展(Scheme 1)。當底物1的芳基對/間位含有鹵素、甲基、甲氧基、叔丁基等時,均可與2a順利反應,獲得相應的產物3b-3j,收率為61-88%,er為92:8-99:1。然而,當底物1的芳基鄰位含有取代基時,未能發生反應(空間位阻導致)。其次,脂肪族酰基硅烷也是合適的底物,可以62%的收率得到產物3k,er為69:31。此外,當底物1中的R1與R2從苯基改為甲基時,也與體系兼容,獲得相應的產物3l-3m,收率為56-77%,er為94:6-98:2。值得注意的是,克級規模實驗,同樣可以85%的收率得到產物3a,er為99:1。
(圖片來源:Angew. Chem. Int. Ed.)
緊接著,作者對吲哚醛底物2的范圍進行了擴展(Scheme 2)。首先,當底物2中的R1為甲基、鹵素時,均可順利與1a反應,獲得相應的產物4a-4e,收率為63-83%,er為92:8->99:1。其次,當底物2中的R2為甲基、鹵素、甲氧基時,均與體系兼容,獲得相應的產物4f-4m,收率為51-90%,er為90:10-99:1。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn