- 首頁
- 資訊
JACS:美國西南醫(yī)學中心Myles W. Smith對稱驅動的Myrioneurinol全合成
來源:化學加原創(chuàng) 2022-06-22
導讀:近日,UT西南醫(yī)學中心的Myles W. Smith課題組在JACS上報道了Myrioneuron生物堿Myrioneurinol的全合成,這是通過識別其多環(huán)結構中隱藏的對稱性而實現(xiàn)的。通過在關鍵的去對稱化過程中使用廉價的手性胺,構建了天然產(chǎn)物的四個手性中心(包括核心季碳中心),為該化合物提供了首例不對稱合成途徑。從商業(yè)可得起始原料出發(fā),共18步完成了全合成,總產(chǎn)率約1%。文章鏈接DOI:10.1021/jacs.2c04487
圖1. 研究背景及本文的對稱驅動策略(圖片來源:J. Am. Chem. Soc.)Myrioneuron生物堿是從Myrioneuron屬的各種植物中分離出來的一類多環(huán)天然產(chǎn)物(如1-6,圖1A)。盡管數(shù)量有限,但這些生物堿顯示出一系列生物活性,包括抗瘧、抗病毒和細胞毒性。由于這些生物堿具有挑戰(zhàn)性的結構以及潛在的生物學活性,引起了合成化學家的興趣。Bodo課題組、蘭州大學厙學功課題組、加州理工Stoltz課題組、賓夕法尼亞州立大學的Weinreb課題組等都有精彩的合成報道。
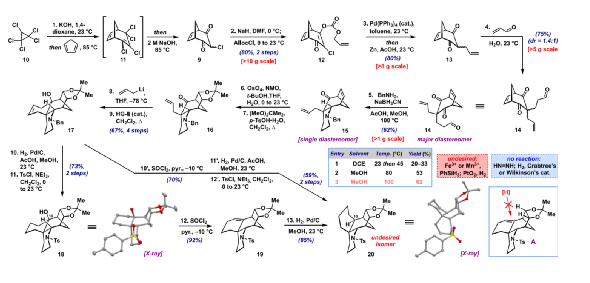
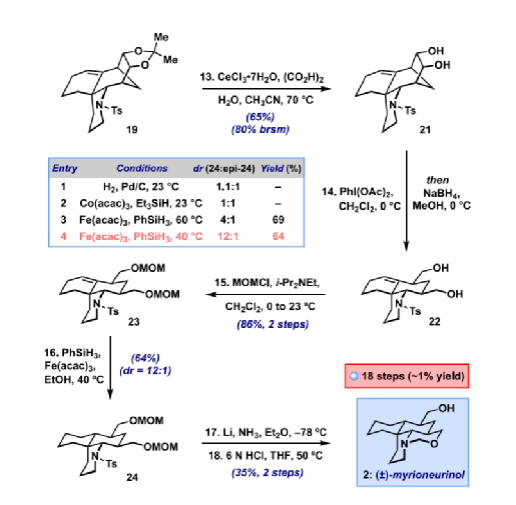
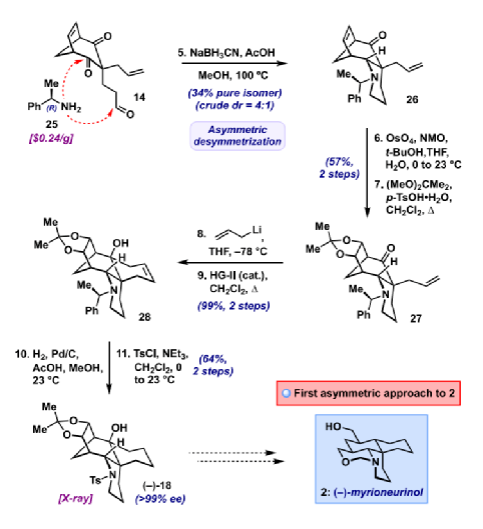
Myrioneurinol (2)是結構最復雜的非二聚體Myrioneuron生物堿之一。該化合物于2007年由Bodo等人分離出來,并顯示出抗瘧活性以及對KB細胞增殖的弱抑制作用。2014年,Weinreb課題組利用兩個關鍵Michael反應和后期分子內Sakurai反應以外消旋形式合成了該分子,共27步得到(±)-2(圖1B)。2022年,華南理工馬志強課題組通過分子內[2+2]環(huán)加成/retro-Mannich/Mannich方法從(6-iodohex-1-炔基)三甲基硅烷以更簡潔的路線合成了(±)-2。在此,Myles W. Smith課題組報道了一種獨特的Myrioneurinol的全合成,通過識別其復雜骨架內的隱藏對稱性,為該目標化合物提供了首例不對稱策略。合成2的主要挑戰(zhàn)在于構建其稠合哌啶、噁嗪和環(huán)己烷環(huán)的四環(huán)體系,并對其五個手性中心(包括一個核心季碳中心)進行立體控制。去對稱化方法可以通過同時從前手性或內消旋底物構建多個手性中心來大大加快復雜目標分子的合成,當合成目標中不具有任何固有的對稱元素且可通過逆合成斷開逆推至對稱前體來揭示“隱藏的對稱性”時,去對稱化策略將變得更加有效。作者對Myrioneurinol(2)的逆合成如圖1C所示。結合兩個順式-羥甲基單元之一的噁嗪環(huán)可能來自雙環(huán)烯烴7的氧化裂解和隨后的環(huán)化。斷開7的D環(huán)的C6-C17鍵和哌啶A環(huán)C2-N/C10-N鍵,逆推到相對簡單的對稱二酮醛8。雙環(huán)8提供了一個機會,可以在C-2醛和兩個前手性酮之一上進行關鍵的去對稱雙還原胺化以形成哌啶A環(huán),剩下的酮可用于隨后的碳環(huán)構建。二酮8可通過已知的氯二酮9的順序烷基化得到。圖2. 四環(huán)烯烴19的合成(圖片來源:J. Am. Chem. Soc.)具體合成路線如下:從商業(yè)五氯環(huán)丙烷10出發(fā),通過已知的一鍋法:消除HCl得到環(huán)丙烯,再與環(huán)戊二烯發(fā)生Diels-Alder反應及環(huán)丙烷開環(huán)得到11,隨后的堿性水解制備十克規(guī)模的9(圖2)。粗品9轉化為O-Alloc衍生物12,產(chǎn)率80%(2步),然后用催化量Pd(PPh3)4進行脫羧C-烯丙基化,得到中間體2-氯-2-烯丙基二酮,同一鍋中加入Zn和AcOH 得到13。13對丙烯醛進行溫和的Michael加成,以75%的產(chǎn)率提供了關鍵的三羰基前體14,dr(1.4:1)。有了不可分離的二酮醛14差向異構體混合物,接下來就是關鍵的去對稱雙還原胺化。首先,選擇使用N-芐胺合成(±)-15,初步篩選確定NaBH3CN和AcOH分別是最佳還原劑和酸促進劑。通過進一步的試驗,確定高溫(100 °C)是這種轉化成功的關鍵。通過1H NMR 進行的反應監(jiān)測表明,醛的第一次還原胺化在室溫下基本上立即發(fā)生,而在大位阻酮上的第二次還原環(huán)化需要高溫才能有效進行。最終,可在克級規(guī)模上以62%的收率獲得三環(huán)胺15,為單一非對映異構體。這種轉化構建了具有正確相對構型的哌啶A環(huán)。接下來,張力雙環(huán)烯烴的化學選擇性二羥基化,然后是丙酮叉保護,產(chǎn)生了單一非對映異構體的掩蔽二醇16,為后面的氧化裂解奠定了基礎。然而,酮16的烯丙基化非常困難。最終,該步驟僅通過使用過量(10 eq.)烯丙基鋰才能實現(xiàn),干凈地提供了烯丙基加合物的單一非對映異構體。使用Hoveyda-Grubbs二代(HG-II)催化劑對這種粗二烯進行關環(huán)復分解(RCM),從15開始經(jīng)4步以67%的收率得到五環(huán)烯烴17,只需一次柱色譜純化。隨著最終碳環(huán)的固定,多余的烯烴可以被氫化(H2、Pd/C、AcOH、MeOH),同時伴隨著NBn基團的氫解。將粗仲胺重新保護為N-對甲苯磺酰胺得到化合物18,其相對構型可通過X-射線晶體學分析確認。此時,可以構建2的C-10手性中心,這需要叔醇18脫氧并保持構型。雖然Barton-McCombie條件由于無法衍生這種受阻羥基而失敗,但用SOCl2/吡啶消除可得到烯烴19(92%),然后是烯烴氫化(85%),得到飽和產(chǎn)物20的單一非對映異構體。將17更早地消除為其相應的二烯,其同樣可以進行氫化/脫芐基化和N-對甲苯磺酰基保護(59%,2步)以提供相同的還原產(chǎn)物20。不幸的是,單晶證明所獲得的非對映異構體具有與 Myrioneurinol相反的C-10構型。通過各種氫原子轉移(HAT)、均相和多相催化氫化19來反轉立體選擇性都未能成功,這可能是由于附近橋環(huán)體系的空間位阻所致。由于Myrioneurinol(2)最終不需要這種雙環(huán)亞結構,作者試圖通過在烯烴氫化之前裂解橋接系統(tǒng)來緩解這個空間位阻問題(圖3)。該計劃的第一步,即19的丙酮叉去保護,在篩選了各種條件后,發(fā)現(xiàn)一種溫和的三氯化鈰/草酸體系可以65%的產(chǎn)率提供二醇21以及一些回收的19 (18%)。用PhI(OAc)2氧化裂解二醇,然后在同一鍋中還原所得二醛,產(chǎn)生橋連裂解的伯二醇22,以兩步86%的產(chǎn)率生成雙-MOM醚23。圖3. (±)-Myrioneurinol(2)的合成(圖片來源:J. Am. Chem. Soc.)隨著烯烴在23和其前體二醇22中的拓撲結構發(fā)生變化,作者嘗試對其進行氫化。它在標準氫化條件下產(chǎn)生了1.1:1的非對映異構體混合物。令人高興的是,23的HAT還原能夠有利于所需的異構體,使用Baran的Fe-催化體系優(yōu)化條件,以64%的產(chǎn)率提供所需的飽和化合物24為主要產(chǎn)物(dr = 12:1)。三環(huán)24是先前Weinreb合成中的已知中間體。對24進行Li/NH3對甲苯磺酰基去保護,然后分別通過酸介導的噁嗪形成和去保護對MOM-醚進行局部去對稱化,得到外消旋的Myrioneurinol[(±)-2],兩步產(chǎn)率為35%。基于去對稱化的策略的一個關鍵優(yōu)勢是它很容易實現(xiàn)Myrioneurinol的不對稱合成。因此,在雙還原胺化中用廉價的(R)-α-甲基苯甲胺(25)代替芐胺會得到對兩種非對映體酮之一,可通過柱色譜法以34%的收率分離得到純的主要異構體26(圖4)。這種轉化一步完成了Myrioneurinol(2)的五個手性中心中的四個的絕對構型,包括季碳中心。異構體26可以與外消旋芐基類似物進行相同的反應序列(通過中間體27和28)得到(-)-18(> 99% ee),其絕對構型由單晶確證。(-)-18的合成因此也實現(xiàn)了(-)-ent-Myrioneurinol[(-)-2]的形式不對稱合成;鑒于(S)-α-甲基芐胺同樣可用,通過這種方法可容易地獲得天然(+)-對映異構體。圖4. (-)-Myrioneurinol(2)的形式合成(圖片來源:J. Am. Chem. Soc.)總結:Myles W. Smith課題組開發(fā)了一種18步全合成Myrioneurinol(2)的方法及 (-)-2的首例形式合成。本文的合成利用隱藏的對稱性來構建其多環(huán)骨架,以雙環(huán)二酮醛的關鍵去對稱雙還原胺化為中心,以立體控制的方式組裝其核心環(huán)系。在此過程中使用廉價的對映純手性胺為Myrioneurinol骨架提供了方便的不對稱途徑。該合成的其他特征還包括將2的順式雙(羥甲基)單元掩蔽為雙環(huán)烯烴、通過底物拓撲結構控制的非對映選擇性烯烴氫化。這種對稱驅動的方法還將用于其它Myrioneuron生物堿的全合成。
參考資料:https://mp.weixin.qq.com/s/vFcSA_JY8N88Hu5Mu_XwVA
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn