

(圖片來源:Angew. Chem. Int. Ed.)
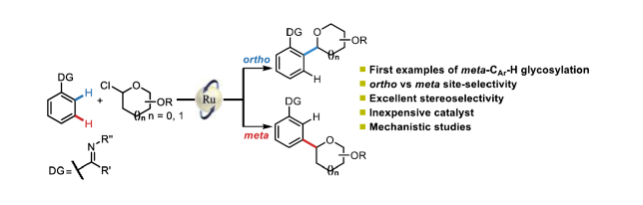
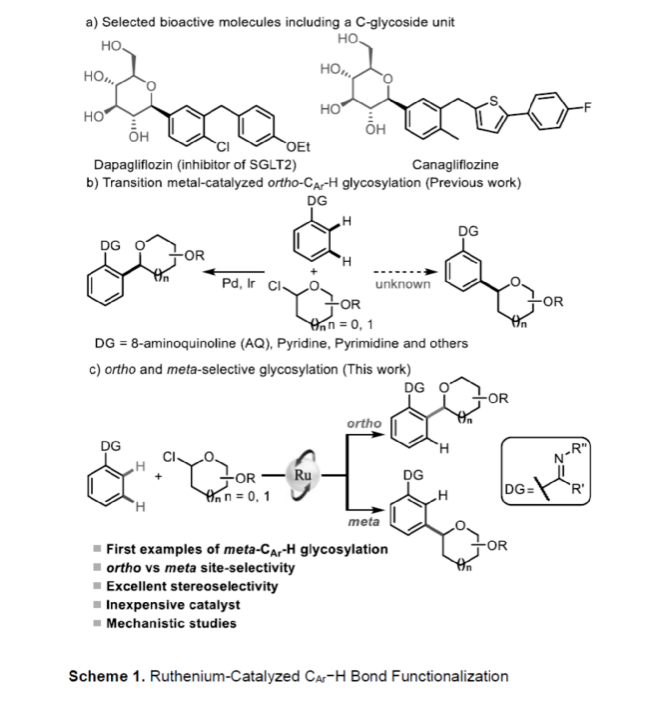
C-糖苷類化合物在生物化學和藥物化學領域中具有重要應用,如具有廣譜抗病毒活性的吡唑霉素和針對II型糖尿病的SGLT2抑制劑達格列凈(Scheme 1a)。同時,糖苷骨架的修飾是調節相關藥物分子活性的有效方法。近年來,芳基糖苷的合成已取得了重大進展。其中,過渡金屬催化的交叉偶聯反應是合成一系列芳基C-糖苷的常用方法。特別是,過渡金屬催化C-H鍵的直接官能團化反應是合成復雜糖苷的高效策略。2019年,陳弓與何剛團隊首次報道了以8-氨基喹啉(AQ)為輔助基團的鈀催化ortho-C-H鍵的糖基化反應。2020年,梁永民、陳弓等課題組分別開發了一種Pd/NBE催化體系,從而實現了碘苯的ortho-C-H鍵的糖基化反應。此外,也有文獻報道了其他關于鈀或銥催化ortho-C-H鍵糖基化反應的例子(Scheme 1b)。盡管ortho-C-H鍵的糖基化反已取得一定地進展,但meta-CAr-H鍵的糖基化反應仍有待進一步的探索。
芳烴位點選擇性C-H鍵的官能團化反應一直是一個具有挑戰性的課題,而傳統方法幾乎完全取決于取代基的電子效應,從而導致底物范圍有限。最近,過渡金屬催化芳烴meta-C-H鍵的官能團化反應是一種新型的策略。2012年,余金權課題組首次報道了使用基于氰基的導向基團實現了meta-CAr-H鍵的官能團化反應。隨后,導向基團的范圍擴展到8-硝基喹啉、聯苯嘧啶、羧酸衍生物等。同時,Pd/NBE催化體系也是合成間位取代芳烴的有效方法。2000年,Lautens課題組首次使用膦配體來解決體系的兼容性問題。最近,通過將非共價相互作用和過渡金屬催化相結合,也實現了芳烴間位官能團化反應。Hartwig課題組開發了一種基于空間控制的策略,用于meta-C-H鍵的官能團化反應。此外,Frost、Ackermann等課題組通過使用廉價金屬釕催化劑經σ-鍵活化策略,從而實現了一系列芳烴meta-C-H鍵的官能團化反應。在此,蘭州大學梁永民與劉雪原課題組報道了首例釕催化高度立體和位點選擇性ortho-和meta-CAr-H鍵的糖基化反應,合成了一系列C-芳基吡喃糖苷和呋喃糖苷衍生物。
(圖片來源:Angew. Chem. Int. Ed.)
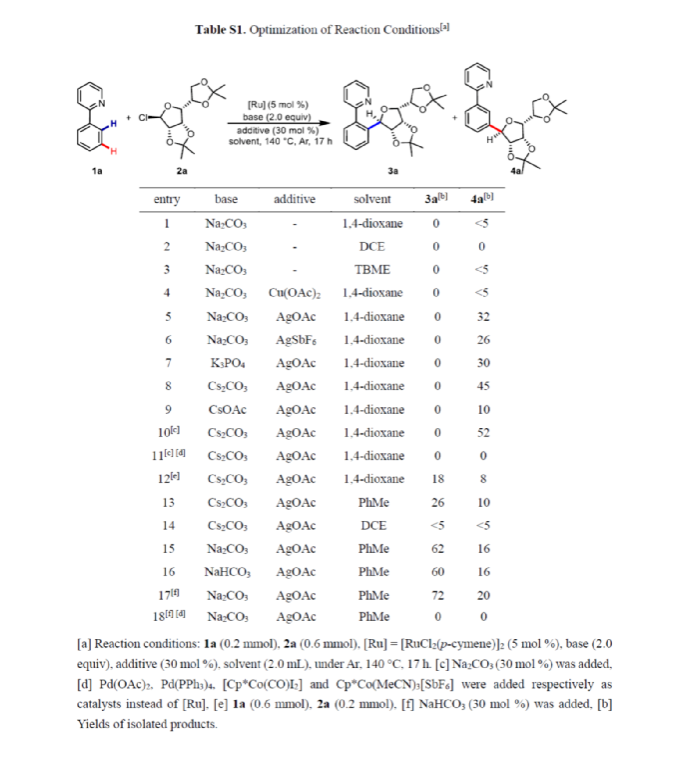
首先,作者以2-苯基吡啶1a與糖基氯供體2a作為模型底物,進行了相關反應條件的篩選(Table S1)。當以[RuCl2(p-cymene)]2作為催化劑,Na2CO3作為堿,AgOAc與NaHCO3作為添加劑,在甲苯溶劑中反應,能以72%的收率獲得鄰位糖基化產物3a(Conditions A)。當以[RuCl2(p-cymene)]2作為催化劑,Cs2CO3作為堿,AgOAc與Na2CO3作為添加劑,在1,4-二氧六環溶劑中反應,能以52%的收率獲得間位糖基化產物4a(Conditions B)。
(圖片來源:Angew. Chem. Int. Ed.)
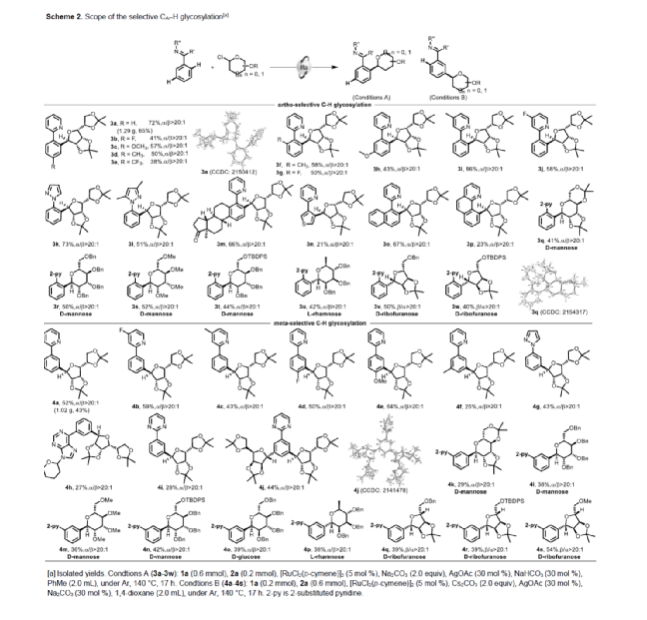
在獲得上述最佳反應條件后,作者對底物范圍進行了擴展(Scheme 2)。首先,在Conditions A條件下,具有不同電性取代的苯基吡啶底物,均可順利反應,獲得相應的鄰位糖基化產物3a-3j,收率為38-86%。苯基吡唑衍生物,也是合適的底物,獲得相應的鄰位糖基化產物3k-3l,收率為51-73%。各種吡啶取代的雜環和芳香環,均與體系兼容,獲得相應的鄰位糖基化產物3m-3p,收率為21-67%。其次,具有不同保護基的甘露糖苷氯,均可與2-苯基吡啶順利發生反應,獲得相應的鄰位糖基化產物3q-3t,收率為41-52%。具有不同取代基的α-鼠李糖基氯和α-呋喃核糖基氯,也是合適的底物,獲得相應的鄰位糖基化產物3u-3w,收率為40-50%。此外,在Conditions B條件下,具有不同電性取代的苯基吡啶底物,均可順利反應,獲得相應的間位糖基化產物4a-4f,收率為25-64%。同時,N-取代的6-苯基嘌呤,也與體系兼容,獲得27%收率的間位糖基化產物4h。當使用苯基嘧啶作為底物時,可同時獲得單取代間位糖基化產物4i(28%收率)和雙取代間位糖基化產物4j(44%收率)。其次,具有不同保護基的α-甘露糖基氯、α-葡萄糖基氯、α-鼠李糖基氯和α-呋喃核糖基氯,均可與2-苯基吡啶順利發生反應,獲得相應的間位糖基化產物4k-4s,收率為29-54%。值得注意的是,上述所有過程均具有出色的立體選擇性,即α/β> 20:1或β/α > 20:1。
(圖片來源:Angew. Chem. Int. Ed.)
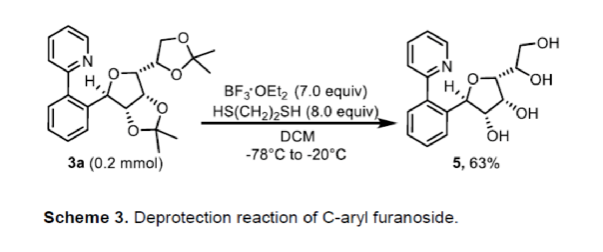
緊接著,作者發現,3a可在二巰基乙烷和三氟化硼乙醚條件下進行脫保護,可獲得含有多個游離羥基的糖苷5,收率為63%(Scheme 3)。
(圖片來源:Angew. Chem. Int. Ed.)
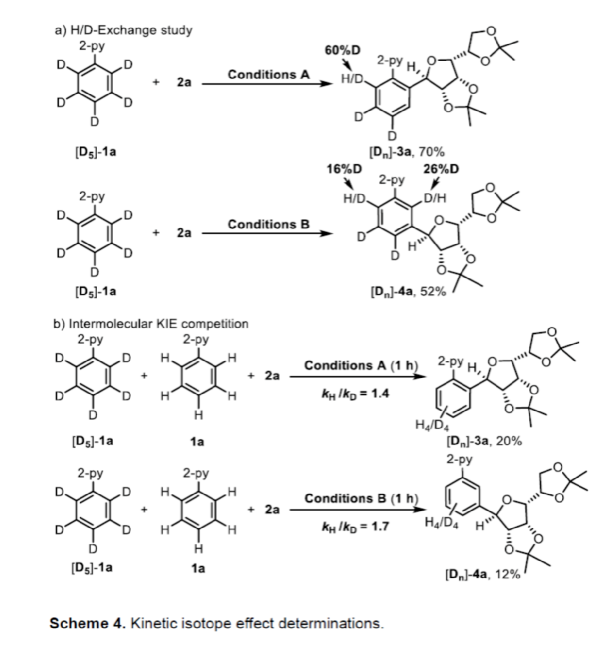
為了進一步了解反應的機理,作者進行了相關的實驗研究(Scheme 4)。首先,[D5]-1a和2a在Conditions A或B條件下反應時,產物[Dn]-3a和[Dn]-4a的鄰位存在明顯的D/H置換,從而表明ortho-C-H環釕化(cycloruthenization)步驟的可行性和可逆性(Scheme 4a)。其次,1a和[D5]-1a的分子間動力學實驗表明,ortho-C-H鍵的斷裂在ortho-或meta-CAr-H鍵的糖苷化反應中與動力學上不相關(Scheme 4b)。
(圖片來源:Angew. Chem. Int. Ed.)
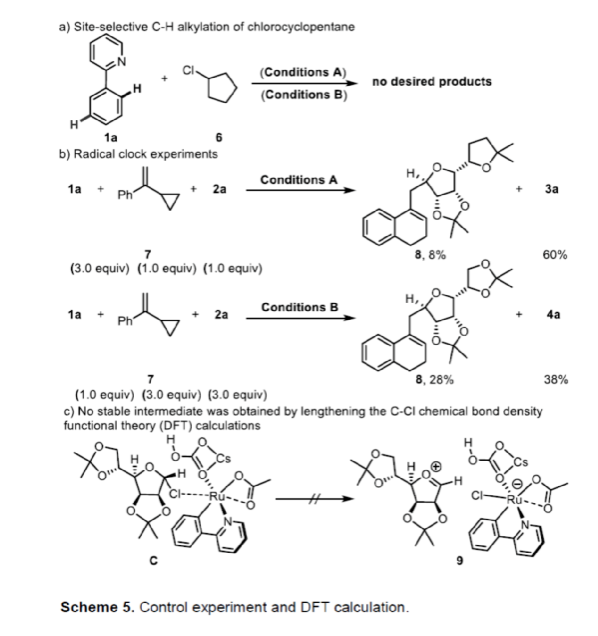
此外,當使用氯代環戊烷6作為底物(代替氯糖),在Conditions A或B下進行反應時,未能生成目標產物,從而表明C-H鍵的糖基化和烷基化反應是不同的(Scheme 5a)。同時,1a、2a與7在Conditions A條件下反應,可獲得60%收率的鄰位糖基化產物3a以及少量的閉環產物8。基于上述的研究以及相關文獻的查閱,ortho-CAr-H鍵的糖基化反應涉及C-H鍵的環釕化、氧化加成和還原消除的過程。1a、2a與7在Conditions B條件下反應,可獲得38%收率的間位糖基化產物4a以及28%收率的閉環產物8,從而表明自由基和碳正離子都可能參與該反應(Scheme 5b)。然而,通過DFT計算表明,meta-CAr-H鍵糖基化反應通過σ-活化策略進行,涉及自由基的過程(Scheme 5c)。
(圖片來源:Angew. Chem. Int. Ed.)
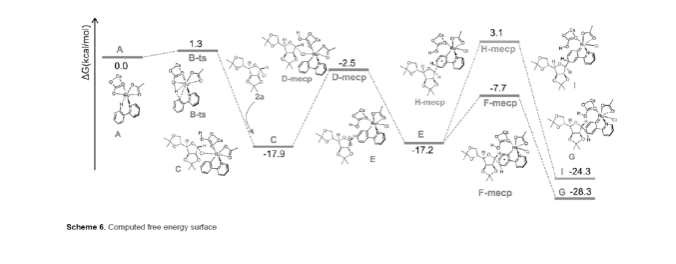
最后,作者通過DFT計算,進一步驗證了meta-CAr-H鍵糖基化反應的機理以及立體選擇性的起源(Scheme 6)。
(圖片來源:Angew. Chem. Int. Ed.)
總結:蘭州大學梁永民與劉雪原課題組報道了一種釕催化高度立體選擇性ortho-和meta-CAr-H鍵的糖基化反應,合成了一系列C-芳基吡喃糖苷和呋喃糖苷衍生物。同時,該策略底物范圍廣泛,各種N-雜環導向基團均與體系兼容。機理研究表明,ortho-CAr-H鍵的糖基化可能涉及關鍵的氧化加成/還原消除過程,meta-CAr-H鍵的糖基化反應是通過σ-活化策略進行。此外,DFT計算表明,空間位阻導致meta-CAr-H鍵糖基化具有高立體選擇性。
參考資料:https://mp.weixin.qq.com/s/h4MWJT_xYZoQOqUK37rIRA
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn