

蛋白病理性淀粉樣聚集廣泛存在于不同神經退行性疾病患者腦中(如阿爾茲海默病,帕金森病,漸凍人癥等),并作為相應疾病的臨床病理標志物,在神經退行性疾病的分型、診斷和藥物研發中起到重要作用。然而,長期以來,對于蛋白病理聚集體在神經退行性疾病中扮演的角色(發病原因VS.伴生現象或結果)存在一些爭議,人們對蛋白病理性聚集的認識曾長期滯留在蛋白質的錯誤折疊與失活聚集的階段。近年來,冷凍電鏡螺旋重構、固態核磁共振及電子衍射等技術的進步極大地推動了本領域的發展,使我們逐漸有機會在原子分辨率水平探究病理蛋白纖維聚集體組裝的分子機制。在過去幾年中一系列重要研究發現表明,蛋白纖維聚集體的構象具有高度的結構有序性及多態性,并且,不同纖維聚集構象展現出不同的病理毒性。這顛覆了人們對于蛋白病理聚集的傳統觀念,為深入理解蛋白相變聚集的復雜組裝機制及其在神經退行性疾病中的關鍵病理作用提供了前所未有的機遇,但同時也引發出一系列新的重要科學問題。例如:淀粉樣纖維聚集體為何會表現出獨特的結構多態性?不同病理條件下,聚集體結構多態性是如何被調控和決定的?不同構象的病理纖維聚集體在不同甚至相同的神經退行性疾病的致病過程扮演什么角色?
交叉中心劉聰課題組長期聚焦于蛋白病理性聚集的分子機制、化學調控和病理毒性的研究,揭示了病理性蛋白聚集的結構多態性,系統闡釋了化學修飾、遺傳突變、代謝小分子等對蛋白纖維聚集的動態組裝和病理毒性的精密調控機制。基于在本領域長期的系統性研究成果,近期特受邀在Nature Reviews Neuroscience雜志上發表了題為“Conformational strains of pathogenic amyloid proteins in neurodegenerative diseases”的長篇綜述性文章。該文章全面、系統地總結了近幾年來對于蛋白致病淀粉樣聚集多態性的結構基礎及分子機制的研究,探討了聚集體構象多態性產生的結構基礎以及在不同類型的神經退行性疾病中的病理學意義。特別需要指出的是,作者在綜述中首次提出蛋白纖維聚集體“構像原型(prototype)”和“病理功能畫像(pathological profile)”這兩個新的概念,闡釋在不同的病理環境下,蛋白纖維聚集體結構的演化關系,并提出應從多個不同病理毒性特征維度來定義與刻畫具有不同結構特征的蛋白病理聚集體在相應疾病中所呈現的綜合病理毒性。這兩個新的概念為理解具有高度復雜有序結構的蛋白病理聚集體在神經退行性疾病中的病理作用具有指導意義。
作者在綜述中首先提出蛋白病理纖維聚集體的兩個關鍵結構特征:同構性(isomorphism)和多態性(polymorphism)。對纖維同構性的了解有助于尋找神經退行性疾病發病機制的共性,開發廣譜的藥物。而纖維聚集結構的多態性則對于理解高度異質性的神經退行性疾病的發病機制至關重要。蛋白聚集結構多態性,是指同一種蛋白具有在不同病理條件下形成不同聚集結構與病理毒性的淀粉樣纖維聚集體(即strains)的性質。針對神經退行性疾病患者腦組織來源及體外重組的病理纖維的大量研究結果顯示,不同的蛋白纖維strains能夠影響不同的細胞類型并在不同的腦區進行傳播,對應臨床表型的異質性。揭示不同strains的結構與相應疾病的對應關系將極大的推動神經退行性疾病亞型的精準分類和分子診療的發展。
作者進一步探討了蛋白纖維聚集體的結構多態性的產生機制。天然的蛋白折疊通常形成三維的立體構象,然而在形成淀粉樣纖維時,每個蛋白質單體通常形成富含β折疊且在同一平面展開的二維構象。與此同時,蛋白單體分子層之間通過β折疊之間的分子間氫鍵網絡沿纖維軸向重復堆疊形成超分子復合體。與蛋白天然構象的三維折疊相比,纖維聚集體的二維折疊缺少更嚴格的分子內限制,導致同一蛋白單體能夠形成多個能量相似的拓撲結構(圖1),從而組裝形成具有多種不同構象的蛋白纖維聚集體。不同纖維結構之間的差異主要包括蛋白單體內β折疊的排列不同,以及原纖維間的相互作用界面不同(圖1)。
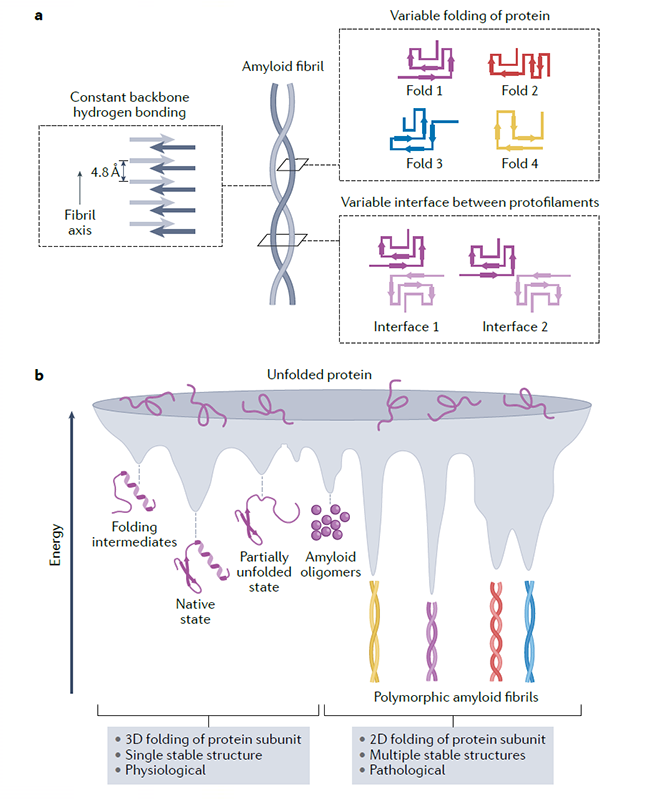
圖1. 病理纖維聚集體的構象多態性的產生機制
接下來,作者詳細闡釋了纖維聚集構象多態性的動態調控機制。蛋白質序列的改變(如錯義突變、截短等)以及共價或非共價化學修飾(如翻譯后修飾、輔因子等),會引起分子內相互作用的重排或者建立新的分子互作模式,從而決定特定病理情況下的纖維聚集組裝結構。通過進一步分析已報道的帕金森病關鍵病理蛋白α-syn的多種纖維聚集體結構,作者提出纖維聚集體“構像原型(prototype)”的概念,闡釋對于特定的病理蛋白,眾多的纖維聚集構象可能衍生于有限的幾個構象原型,在不同的病理環境下,這些構象原型通過不同調控因子的作用,演化形成具有不同結構的病理聚集體。
作者進一步指出,對比現有的大量病理纖維聚集體組裝及調控機制的研究,目前對于不同結構纖維在不同疾病中的致病機制研究還處在非常初期的階段,人們尚無法從現有的結構信息解讀其病理特征。目前已知,病理纖維聚集可以通過多種不同的途徑發揮其病理毒性,驅動疾病的發展,包括:阻遏蛋白質降解、打破蛋白穩態、誘導線粒體等重要的細胞器功能失調、破壞細胞膜,以及病理纖維聚集的自我復制與細胞間傳播。作者認為不同的strains之所以對應不同的病理毒性,是由于構象的變化賦予纖維不同的特性(如:形成以及復制纖維的能力、纖維的穩定性、對細胞降解的敏感性、被細胞攝取的效率等),從而在多個不同角度同時作用來影響上述不同途徑的病理毒性。據此,作者提出pathological profile的概念(圖2),把理解蛋白病理聚集體的病理毒性,放在一個復雜多因素共同決定的模型中,系統性地研究不同構象strains的病理毒性,及其與疾病亞型的因果關聯。
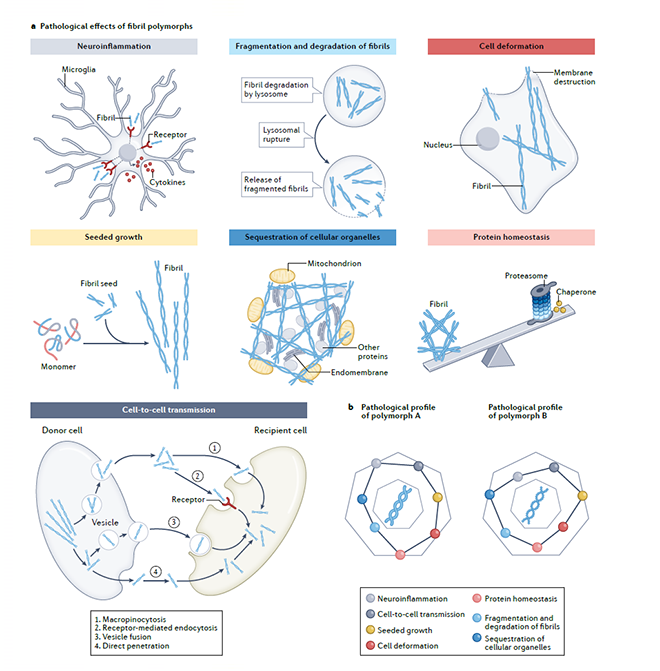
圖2. 具有不同結構的病理纖維聚集體的pathological profile
最后,作者提出在疾病發展過程中,同一蛋白形成的病理聚集體結構與毒性存在動態變化的特征,與病程的發展密切相關。隨著病理纖維聚集體在不同細胞和腦區間傳播,細胞環境的變化能夠通過翻譯后修飾、輔因子等作用,在病理纖維的自我復制過程中發生改變,重塑其結構構象,進而改變病理毒性。未來對于病理纖維聚集體的結構及毒性隨病程變化的深入研究將有助于疾病的精準分子分型、臨床診斷分期,以及針對疾病不同發展階段的特定靶向療法的開發。在文末,作者特別展望了本領域幾個有潛力的未來研究方向,包括:(1)推進基于病理纖維strains的神經退行性疾病的精準分型及分期;(2)靶向特定病理纖維strains的分子診斷示蹤劑和藥物開發;(3)發展體外重構特定結構纖維strains的新方法,以及表征不同strains的pathological profile的化學生物學新工具;(4)發展基于冷凍電鏡斷層掃描技術的細胞原位病理纖維聚集體結構表征技術。
文章鏈接: https://www.nature.com/articles/s41583-022-00603-7
參考資料:http://www.sioc.ac.cn/xwzx/kyjz/202206/t20220610_6459498.html
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn