

在過去的幾十年里,化學家們已從三尖杉屬里分離報道了70多種三尖杉屬二萜類化合物(Cephalotaxus diterpenoids1-9,圖1),這些天然產物大多具有獨特的環系和良好的生物活性。在結構上,這些天然產物包括三尖杉屬C20二萜類化合物(如MannolideC(9))、三尖杉屬C19環庚三烯酮類(如Harringtonolide(7)和Fortunolide A(8))、其它三尖杉屬C19降二萜類化合物(如Cephanolide A(5)和Cephanolide C(6)),以及C18二降二萜類化合物(如Cephanolide A-C(1-3))。
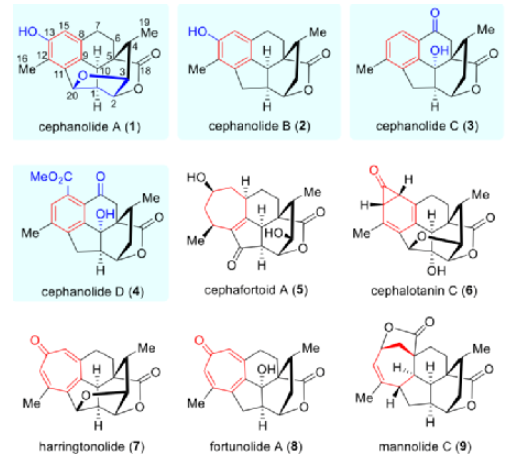
圖1. 代表性的三尖杉屬二萜類天然產物(圖片來源:J. Am. Chem. Soc.)
2017年,岳建民院士團隊從Cephalotaxus sinensis中分離出四種結構獨特的三尖杉屬二萜類Cephanolide A-D(1-4)。Cephanolide A-C(1-3)是A環-收縮的三尖杉屬C18二降二萜,Cephanolide D(4)是一種A環收縮的降二萜。這四種天然產物是迄今為止發現的含苯環三尖杉屬二萜的所有同源物,可能是從抗腫瘤三尖杉屬環庚三烯酮類化合物中生物合成衍生的:三尖杉屬環庚三烯酮(如Fortunolide A(8))中的環庚三烯酮部分的電環化產生含有環丙酮的中間體,隨后經歷Baeyer-Villiger型氧化和水解以提供苯環單元。
由于其獨特的結構特點和良好的生物活性,三尖杉屬二萜類Cephanolides A-D吸引了眾多的合成化學家對其進行合成研究,其中,中國的化學家包括陜西師范大學的趙玉明課題組、華東師范大學的高栓虎課題組、復旦大學的蔡泉課題組以及北京大學的楊震課題組等都在該領域做出了卓越的貢獻,展示了精彩的化學(圖2)。
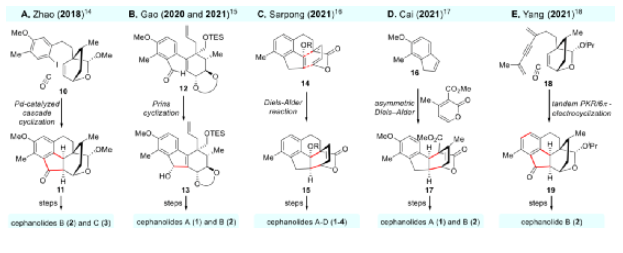
圖2. 已報道的Cephanolides A-D的合成工作(圖片來源:J. Am. Chem. Soc.)
翟宏斌課題組長期致力于三尖杉屬二萜類化合物的合成,已完成C20二萜類Mannolide C(9)和C19環庚三烯酮Harringtonolide(7)的不對稱全合成。由于Cephanolides A-D(1-4)都有一個共同的6-6-5-6四碳環骨架,其中嵌入了一個橋接的δ-內酯,但具有不同的氧化態,實現全合成的關鍵在于高效構建四環核心。作者認為Cephanolides A-D的四環核心應該可以從鹵代烯炔I通過鈀催化的部分分子間串聯反應序列獲得。串聯反應過程始于I的氧化加成,然后是分子內碳鈀化形成三環物種II。II優先與末端炔烴(如果后者比I更具反應性)反應生成III,它可以進行6-endo-trig碳鈀化(形成IV)或6π-電環化(形成V)以提供所需的苯衍生物VI(圖3A)。
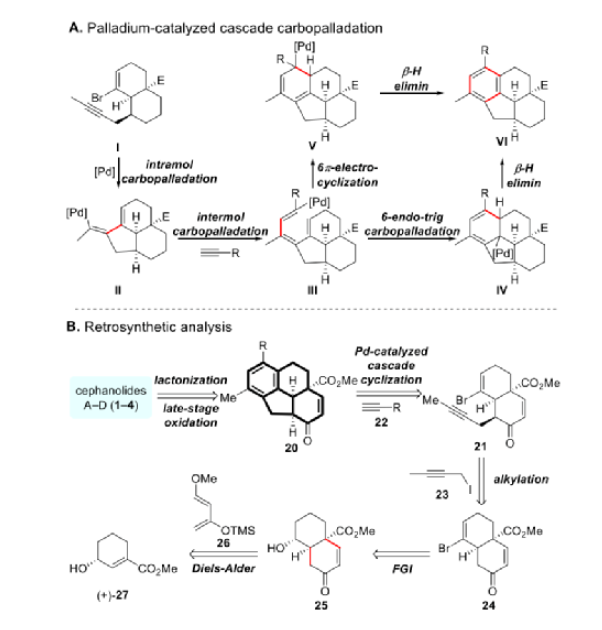
圖3. 關鍵的串聯反應及逆合成分析(圖片來源:J. Am. Chem. Soc.)
Cephanolides A-D (1-4)的逆合成分析如圖3B所示。所有四種目標分子都應該可以通過對共同四環核心20的后期氧化和內酯化來獲得。化合物20可以從溴烯炔21和末端炔烴22通過上述串聯反應序列生成。21可通過烯酮24的烷基化獲得,烯酮24可以從25通過官能團互變(FGI)合成。6-6順式稠環可以通過Danesefsky二烯(26)與手性不飽和酯27的Diels-Alder環加成獲得。
具體合成路線如下:用異丁酸酐酰化已知的手性烯丙醇27以形成二酯28(圖4)。Danishefsky二烯(26)與親二烯體28的分子間Diels-Alder反應在180 °C無溶劑下順利進行,在用K2CO3和MeOH脫酰后得到具有高非對映選擇性(dr >20:1)的順式雙環片段25。28中的異丁酰基對該反應的非對映選擇性至關重要。DMP氧化醇25,以93%的產率生成二酮29。在對反應條件進行廣泛篩選后,二酮29 在與水合肼(1 eq.)在甲醇中回流時轉化為單腙,再和三溴化吡啶鎓反應以中等產率獲得溴代烯烴24。24在C1處與1-碘代-2-丁炔發生立體選擇性單烷基化,值得一提的是,在用相應的溴化物取代碘化物23或在沒有三乙基硼烷的情況下,不可避免地產生雙烷基化副產物。接下來,單烷基化產物30中C1的構型通過連續的烯醇硅醚形成、TBAF去硅基化時立體選擇性質子化而有效地翻轉。
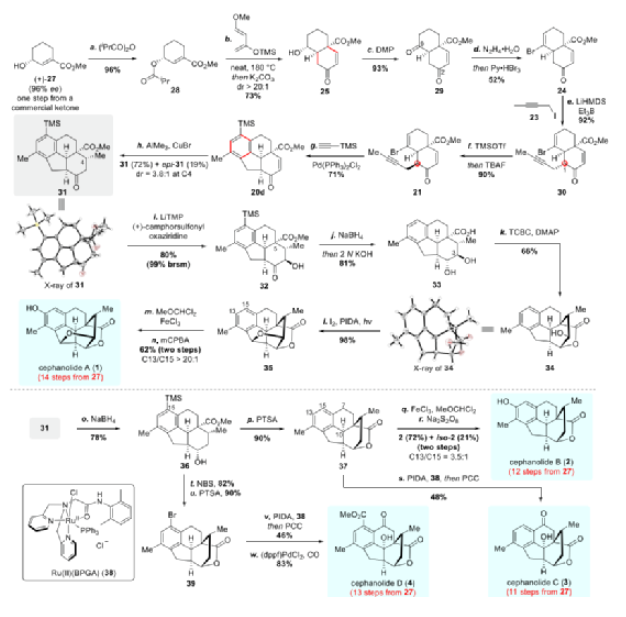
圖4. Cephanolides A-D的全合成(圖片來源:J. Am. Chem. Soc.)
有了溴烯炔21,作者將注意力轉向了關鍵的鈀催化的分子間串聯反應序列以組裝四環骨架。當使用三甲基硅基乙炔作為雙碳源并以Pd(PPh3)2Cl2作為催化劑時,以60%的收率獲得了四環20d。進一步篩選反應條件,當21與22e在Pd(PPh3)2Cl2和Et3N的存在下在DMF中100 °C下反應6 h時觀察到最佳結果。該反應也可以克級規模進行,產率沒有明顯損失。
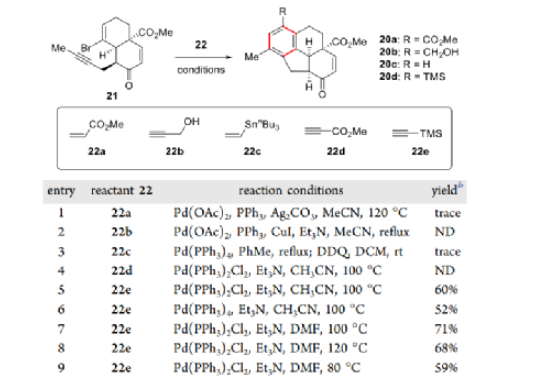
圖5. 串聯反應的條件篩選(圖片來源:J. Am. Chem. Soc.)
在CuBr存在下,烯酮20d和Me3Al立體選擇性Michael加成,以72%的產率提供酮酯31,同時以19%的產率(dr = 3.8:1)得到4-epi-31。31的結構經X-射線晶體學分析確證。
31的α-羥基化僅從β-面進行,并以80%的產率(基于起始原料回收的產率為99%)提供32。C3處出色的立體選擇性更可能是由C5處的酯基引起的1,3-二直立鍵效應造成的,而不是由C4處的甲基所產生的空間位阻影響。NaBH4還原32的C2羰基隨后在一鍋中用2 N KOH皂化酯基,酸化后,在苯環上同時去硅基化,以81%的收率生成羧酸33。此時,完成Cephanolide A (1)的全合成就差內酯和四氫呋喃環的構建以及芳烴單元的羥基化。通過用TCBC/Et3N和DMAP處理實現33的化學選擇性內酯化(不保護C3羥基),產生δ-內酯34,產率為66%。按照Sarpong等人的方案,對醇34進行Suárez氧化以構建THF環,從而以優異的產率得到六環35。1全合成的最后一個挑戰是苯環上的區域選擇性羥基化。作為Sarpong方案的補充,作者通過一個兩步反應序列:(i)在FeCl3存在下用1,1-二氯甲基甲基醚對35進行傅克酰化(形成C13-甲酰化芳烴)和(ii)用mCPBA進行Baeyer-Villiger氧化重排(生成的甲酸酯中間體在反應條件下自發水解),從35開始經兩步以62%的產率和高區域選擇性(C13/C15 > 20:1)得到Cephanolide A (1)。1的合成樣品的譜圖數據與文獻報道相符。
對于Cephanolide B(2)的全合成,化合物31與NaBH4的立體選擇性還原得到仲醇36(78%),其和對甲苯磺酸反應,以90%的收率得到內酯37。化合物36的C2位羥基的構型通過相關2D NMR研究得到證實,該醇的整體結構通過單晶得到進一步驗證。C13芳烴氧化通過類似于Cephanolide A的兩步序列(即傅克甲酰化和Baeyer-Villiger氧化重排),得到Cephanolide B(C13/C15 = 3.5:1)。
Cephanolide C(3)從五環內酯37通過在C7和C10(三個可能的芐位中的兩個)的選擇性氧化獲得。雖然趙玉明課題組在Cephanolide C的全合成中將DDQ應用于選擇性芐基氧化(C10),但針對37,只回收了底物,并沒有獲得C10-羥基化產物,這可能是由于37中的C13(苯環上)缺少供電子的甲氧基所致。在Toma 等人的報道的啟發下,作者隨后研究了鈷催化的TBHP介導的氧化方案。在這種情況下,目標分子3確實是通過C7和 C10的氧化生成的,產率僅為12%。用CrO3/3,5-二甲基吡唑在不同溫度下氧化37,以28-38%的產率產生3,而用CrO3/AcOH或PCC氧化均不成功。2021年,Uchida 等人開發了一種釕催化的化學選擇性和位點選擇性C-H氧化,可用于沒有給電子取代基的芐基氧化。五環37在Ru(II)(BPGA)/PIDA條件下氧化,3的產率為37%,同時產生少量的7,10-二羥基中間體。因此,在一鍋中用Ru(II)(BPGA)(38)/PIDA和PCC依次處理五環37,以48%的產率提供Cephanolide C(3)。
與Cephanolide C(3)相比,Cephanolide D(4)在C15處具有額外的甲氧羰基官能團。用NBS將化合物36溴化,然后在酸性介質中進行內酯化,兩步以74%的產率提供五環內酯39。類似于Cephanolide C(3)的合成,C7和C10的選擇性芐位氧化是通過在一鍋中用Ru(II)-(BPGA) (38)/PIDA和PCC連續處理來完成的,而不會脫掉底物中的溴原子。最后,Pd-催化的甲氧基羰基化,以83%的產率得到Cephanolide D(4)。
總結:翟宏斌課題組開發了一種高效的發散策略,從已知的手性醇27出發,經11-14步完成了Cephanolides A-D的不對稱全合成。該合成的亮點包括:(i)底物控制的非對映選擇性分子間Diels-Alder反應形成高度功能化的6-6順式稠環,(ii)鈀催化的形式雙分子[2 + 2 + 2]環加成反應,通過涉及多個碳金屬化的分子間串聯反應序列快速安裝關鍵的四環骨架,以及(iii)通過位置選擇sp3(芐位)和sp2(苯環上)C-H氧化進行后期氧化多樣化,從而實現了四種天然產物的發散性全合成。該合成工作將有助于各種三尖杉屬二萜的大規模制備和進一步的生物活性研究。
參考消息:https://mp.weixin.qq.com/s/vRfmc3JWNxUtpMp_yrbQ_Q
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn