- 首頁
- 資訊
華中師范大學肖文精與陸良秋團隊JACS:光輔助鈷催化實現芳基碘的不對稱還原Grignard-型加成反應
來源:化學加原創 2022-05-13
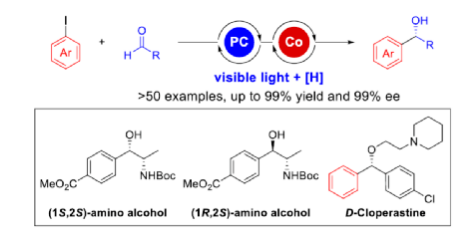
導讀:Grignard加成反應是合成醇類化合物最為重要的方法之一。然而,在不對稱催化領域中主要依賴于有機金屬親核試劑的使用。近日,華中師范大學肖文精與陸良秋團隊首次報道了一種可見光誘導鈷催化不對稱還原Grignard-型加成反應,并合成了一系列手性苯甲醇衍生物。同時,該策略具有反應條件溫和、官能團兼容性高、對映選擇性優異、無需使用貴金屬催化劑等特點。動力學實驗表明,芳基鈷配合物遷移插入至醛中的過程是還原加成反應中的決速步驟。文章鏈接DOI:10.1021/jacs.2c02481
(圖片來源:J. Am. Chem. Soc.)
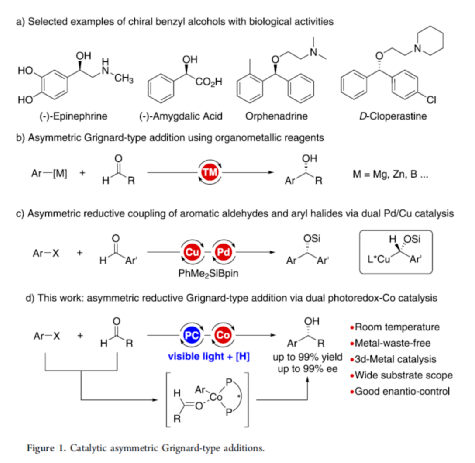
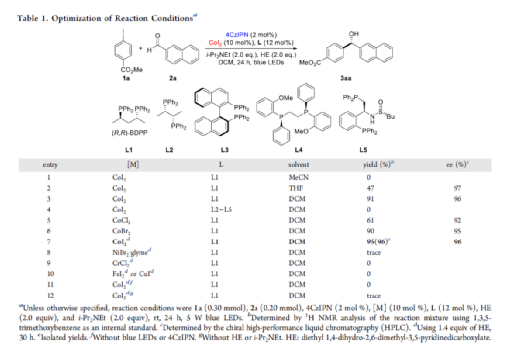
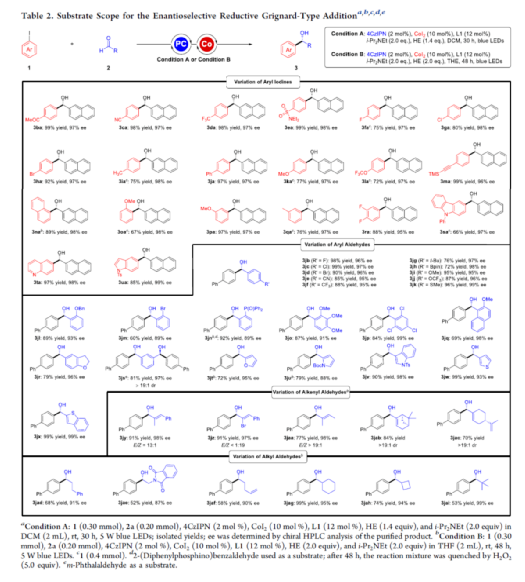
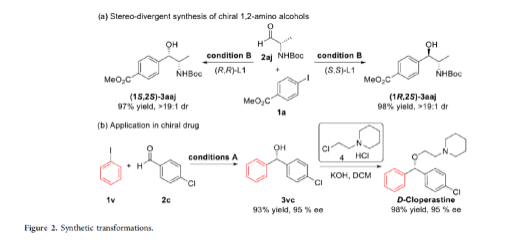
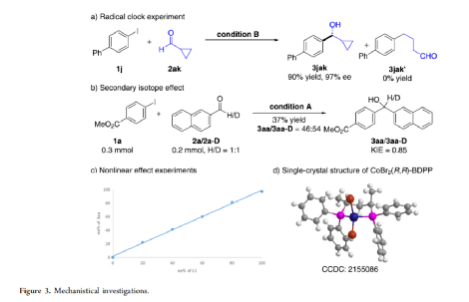
手性苯甲醇是一種重要的結構單元,廣泛存在于天然產物、藥物和材料等中(Figure 1a)。因此,對于手性苯甲醇分子的合成具有重要的意義。其中,過渡金屬或酶催化酮的不對稱氫化反應是最為環保、原子經濟性的方法。相比之下,過渡金屬催化有機金屬試劑(Mg、Zn、B等)與羰基化合物的不對稱還原Grignard-型加成反應,是合成苯甲醇衍生物的另一種有效的方法(Figure 1b)。然而,此類反應常存在化學計量有機金屬試劑的使用、反應條件苛刻、生成金屬廢物等問題。目前,使用芳基鹵代替金屬試劑的還原偶聯策略是一種具有前途的方法,具有反應條件溫和且步驟經濟性高等特點,但對于催化不對稱策略的開發僅有少數成功的例子。2006年,Cheng課題組報道了一種鈷催化2-碘苯甲酸酯和醛的不對稱環化反應。隨后,也報道了相關Pd-或Ni-催化芳基鹵與酮的分子內不對稱加成反應。盡管已取得一定的進展,但通過一般芳基鹵和醛合成光學純醇的策略仍具有挑戰。直至2019年,Ohmiya課題組報道了一種Pd/Cu雙重催化芳香醛與芳基鹵的不對稱還原偶聯反應(Figure 1c)。在此,華中師范大學肖文精與陸良秋團隊首次報道一種可見光誘導鈷催化不對稱還原反應,涉及芳基鹵與芳基/烷基醛的Grignard加成過程,并以優異的收率與對映選擇性獲得一系列手性苯甲醇衍生物(Figure 1d)。首先,作者以4-碘苯甲酸甲酯1a與2-萘醛2a作為模型底物,進行了相關不對稱還原反應條件的篩選(Table 1)。當以4CzIPN作為有機光催化劑,CoI2作為金屬催化劑,L1作為配體,i-Pr2NEt作為縛酸劑,HE(Hantzsch ester)作為還原劑,在DCM溶劑中于藍色LED輻射下反應,能以95%的收率和96%ee獲得手性醇產物3aa。在獲得上述最佳反應條件后,作者首先對芳基碘的底物范圍進行了擴展(Table 2)。研究表明,芳基碘的芳基上含有一系列不同電子性質的取代基時,均可順利反應,獲得相應的產物3ba-3ra,收率為67-98%,ee為95-98%。其中,帶有吸電子基團的芳基碘底物具有更高的反應性。同時,一系列雜環取代的碘化物,如咔唑、喹啉和吲哚基,同樣與體系兼容,獲得相應的產物3sa-3ua,收率為66-97%,ee為97-99%。緊接著,作者對芳香醛的底物范圍進行了擴展。研究表明,苯甲醛的對位含有一系列不同電子性質的取代基時,均可順利反應,獲得相應的產物3jb-3jk,收率為72-99%,ee為95-99%。值得注意的是,具有硼酸酯取代的苯甲醛底物,同樣能夠與體系兼容,如3jh。對于苯甲醛的鄰位含有一系列不同的取代基時,也可順利進行反應,獲得60-92%收率的相應產物3jl-3jq,但對映選擇性有所降低(89-99% ee)。有趣的是,當以1,3-苯二醛(2s)作為底物時,可獲得高光學純的手性二醇3js,收率為81%,ee為97%,dr > 19:1。對于一系列雜芳基取代的醛,同樣是合適的底物,獲得相應的產物3jt-3jx,收率為72-99%,ee為88-99%。此外,一系列多取代的α,β-不飽和醛也成功進行反應,獲得優異E/Z比的相應產物3jy-3jaa,收率為77-91%,ee為97-98%。天然手性桃金娘醛(myrtenal,2ab)和紫蘇醛(2ac)也與體系兼容,獲得70-84%收率的產物3jab和3jac,dr > 19:1。值得注意的是,一系列烷基醛(2ad-2ai)也可順利反應,獲得相應的產物3jad-3jai,收率為52-99%,ee為87-99%。隨后,作者對反應的實用性進行了研究(Figure 2)。首先,以手性氨基醛2aj與1a作為底物,可直接合成具有價值的手性1,2-氨基醇衍生物,即兩種非對映異構體(1S,2S)-3aaj和(1R,2S)-3aaj,收率為98-99%,dr > 19:1(Figure 2a)。其次,以1v與2c作為底物,通過兩步串聯策略,可直接合成高光學純的中樞性鎮咳藥D-氯哌斯汀(Figure 2b)。此外,作者還對反應機理進行了進一步的研究(Figure 3)。首先,1j與環丙基甲醛2ak在標準條件下進行自由基鐘實驗時,未生成自由基開環偶聯產物3jak',僅獲得還原加成產物3jak,從而表明在光氧化還原條件下,醛未經單電子還原生成自由基陰離子配合物(Figure 3a)。其次,在標準條件下使用1a與2a/2a-D進行的KIE實驗表明,芳基鈷配合物遷移插入至醛的過程是還原加成反應中的決速步驟(Figure 3b)。此外,通過非線性實驗表明,該還原Grignard-型加成反應是由鈷/L1配合物(1:1)催化促進(Figure 3c)。該結果與CoBr2(L1)單晶結構的結果一致(Figure 3d)。基于上述的研究以及相關文獻的查閱,作者提出了一種合理的催化循環過程(Figure 4)。首先,在可見光照射下,光激發的4CzIPN*經單電子還原生成還原性的4CzIPN?-,可通過單電子轉移將Co(II)/L1配合物轉化為低價的Co(I)/L1配合物。隨后,芳基碘與Co(I)/L1配合物進行氧化加成生成芳基Co(III)/L1配合物。接下來,芳基Co(III)/L1配合物被另一個4CzIPN?-還原生成芳基Co(II)/L1配合物。在與醛進行配位后,芳基Co(II)/L1配合物對羰基的碳進行高度立體專一性的Grignard-加成后,從而生成手性醇陰離子。最后,經質子化后,即可獲得目標產物。然而,目前也不能排除芳基Co(III)/L1配合物對醛的遷移插入過程。總結:華中師范大學肖文精與陸良秋團隊首次報道一種可見光誘導鈷催化芳基碘和醛的不對稱還原Grignard-型加成反應,并合成了一系列手性苯甲醇衍生物。同時,該策略具有反應條件溫和、底物范圍廣泛、官能團兼容性高、對映選擇性優異、收率高等特點。此外,通過該策略還可實現手性1,2-氨基醇的立體發散性合成以及兩步合成手性D-氯哌斯汀藥物。機理研究表明,芳基鈷配合物遷移插入至醛的過程是還原加成反應中的決速步驟。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn