背景介紹
分子病理作為跨界融合的技術逐漸成為精準醫療的支柱,其在疾病的鑒別診斷、伴隨診斷、分子分型、預后判斷等方面起到極其重要的作用。目前,分子病理學中常用的技術包括高通量基因測序(NGS),熒光原位雜交(FISH),免疫組化(IHC)、基因芯片及PCR技術等。隨著精準醫學的發展,對復雜疾病尤其是惡性腫瘤等疾病的個性化精準治療需要從更多維度的分子角度對病理組織樣本進行分型和判別。由于質譜技術的高通量,免標記特點,質譜成像、質譜組織活檢、流式細胞質譜等技術將成為分子病理領域的重要方向。
脂質與細胞增殖、細胞物質交換與能量交換、細胞信號傳導等重要生理生化過程密切相關。基于空間脂質組學的分子病理研究對于推動精準醫學的發展具有重要意義。質譜成像是空間脂質組學的主要解決方案。其中,基質輔助激光解吸離子化質譜成像( MALDI-MSI)是應用最為廣泛的質譜成像技術,但由于有機小分子基質的背景干擾、結晶不均勻性及前處理時間長等缺點使得常規MALDI-MSI在臨床應用中受到阻礙。化學系鄔建敏課題組此前在免基質脂質分析領域開展了一系列的研究。該課題組利用垂直硅納米線(SiNW)頂端的電磁增強效應,提出了頂端接觸取樣原位離子化質譜技術(TCSI-MS),實現了組織樣本脂質分子的快速獲取(ACS Appl. Mater. Interfaces,2018,10, 14389).與附屬邵逸夫醫院合作成功地將TCSI-MS技術應用于肝癌組織樣本的良惡性判斷和切緣判別 (Anal. Chem. 2019,91, 10376)。TCSI-MS技術通過組織與納米線頂端的接觸,將組織脂質分子轉印到納米線,在后續的質譜分析中,激光轟擊納米線頂端進而實現組織樣本分子的無損分析。該方法支持同一個組織樣本的跨平臺分析,便于獲取多組學分子信號。然而,因硅納米線陣列表面的空間不均勻性,TCSI-MS在組織成像、空間代謝組或脂質組學的應用仍然面臨挑戰。發展一種能高保真呈現脂質分子在組織表面空間分布的免標記成像基板是解決TCSI-MS在分子病理領域應用的關鍵。
近日,浙江大學化學系鄔建敏課題組在ACS Nano上發表了基于組織轉印技術的質譜成像新方法,實現了TCSI-MS在組織分子成像領域的應用。

工作亮點
研究人員首先使用自下而上生長的兩親性氮摻雜石墨烯量子點(NGQD)作為插層劑和分散劑來輔助MoS2的液相剝離,以獲得薄而穩定的NGQD@MoS2二維納米片。然后通過自組裝過程將它們負載到硅納米線(SiNWs)的頂端,獲得一種新型的NGQD@MoS2/SiNWs質譜成像基板(圖1)。
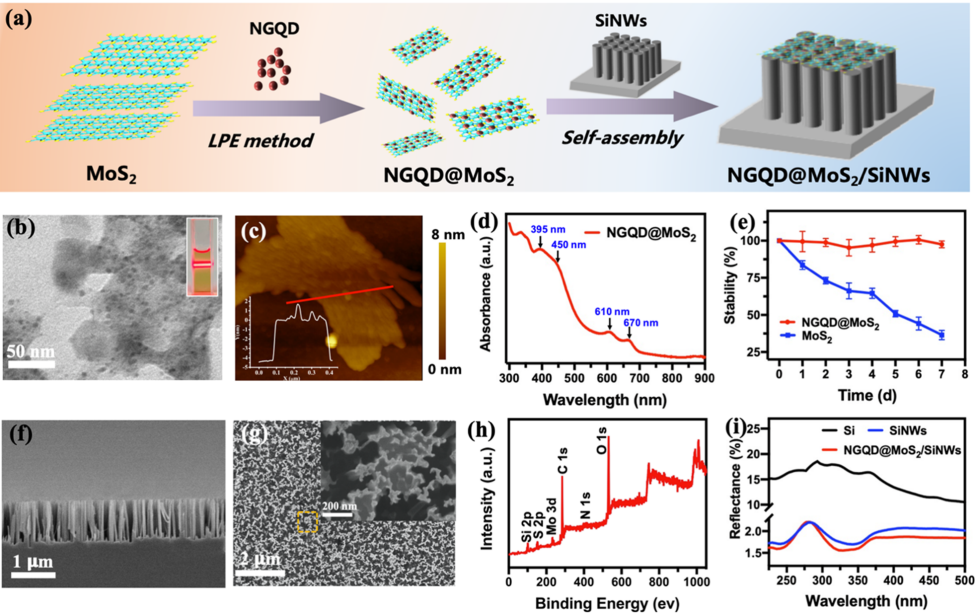
圖 1. (a)NGQD@MoS2/SiNW基板合成流程示意圖;(b)NGQD@MoS2納米片TEM圖像;(c)NGQD@MoS2納米片AFM圖像;(d)NGQD@MoS2納米片紫外吸收曲線;(e)NGQD@MoS2與MoS2納米片穩定性比較;(f)NGQD@MoS2/SiNW截面SEM圖像;(g)NGQD@MoS2/SiNWs表面 SEM圖像;(h)NGQD@MoS2/SiNW XPS譜圖;(i)Si,SiNWs, NGQD@MoS2/SiNWs紫外漫反射曲線。
在脂質標準品測試中,通過與MoS2/SiNWs、NGQD/SiNWs、SiNWs基板對比,NGQD@MoS2/SiNWs基板顯示出優異的LDI性能(圖2 a-f)。同時為了驗證基板表面是否能得到均一的質譜信號(或“sweet-spots"效應的消除),研究人員掃描了整個脂質標品液滴干燥沉積后的區域進行質譜成像,發現NGQD@MoS2/SiNWs基板的信號更強且更為均勻(圖2g)。
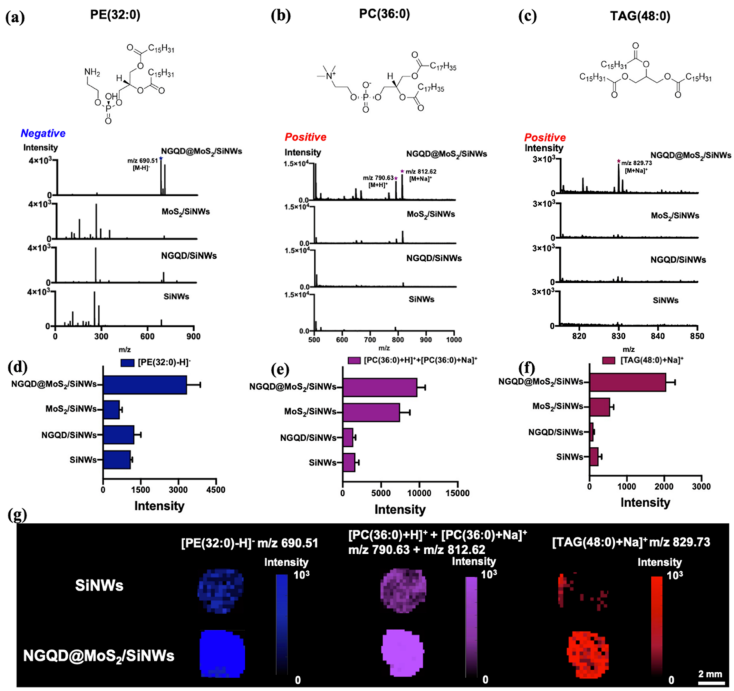
圖 2 (a)-(c)脂質分子結構式及代表性譜圖;(d)-(f)脂質分子在不同基板上的出峰強度對比;(g)脂質分子在不同基板上沉積區域的成像掃描圖。
為研究復合材料的協同作用機制,研究人員用靛藍和芐基吡啶鹽作為模型分子探究了不同基板的表面光致電荷轉移能力、熱解吸及內能轉換效率。從靛藍分子負離子模式下的總離子強度(圖3b)可以看出,NGQD@MoS2/SiNWs基板比SiNWs基板高出40倍,也遠遠高于MoS2/SiNWs及NGQD/SiNWs基板。這可能是由于NGQD@MoS2具有超高的載流子壽命,而NGQD有益于促進電荷轉移并有效抑制光致電子-空穴對的復合。載流子壽命的明顯提升及SiNW-MoS2間P-N異質結的共同作用,使得光致電荷轉移幾率得到極大的提升(圖3d)。通過對芐基吡啶鹽的檢測,發現NGQD@MoS2與SiNWs復合后可將芐基吡啶鹽母離子存活率從54%提升到71%(圖3g),這是由于NGQD@MoS2納米片可以具有sp2結構,與SiNWs復合后,能量可以分散到sp2結構中,從而降低內部能量轉移,減少分子碎片,有助于LDI能力的提升。
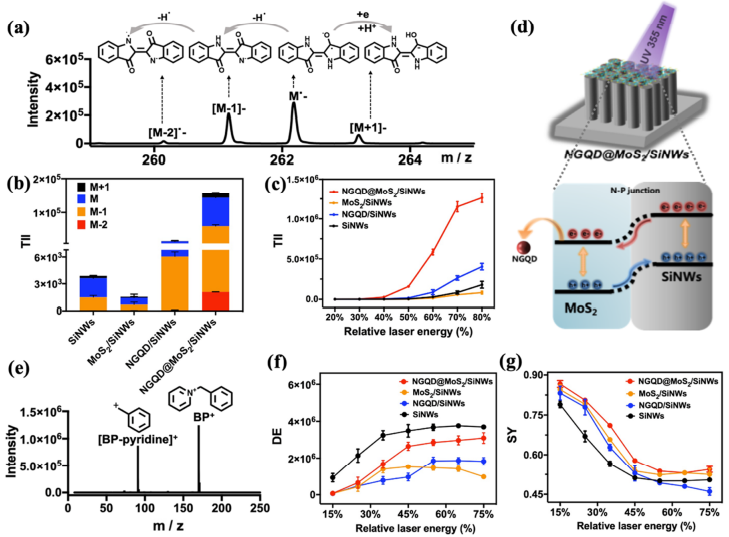
圖 3.(a)靛藍分子在負離子模式下的譜圖;(b)-(c)靛藍分子總離子強度對比圖;(d)協同機理示意圖;(e)芐基吡啶鹽正離子模式譜圖;(f)芐基吡啶鹽總離子強度對比圖;(g)存活率曲線。
得益于NGQD@MoS2/SiNWs基板的高LDI效率和優異的分子成像能力,研究人員成功地對小鼠肺組織進行了印跡質譜成像。在NGQD@MoS2/SiNWs上獲得的脂質數量和總離子強度比在 SiNWs基板上高 4-5倍。成像結果可清晰顯示小鼠肺組織的脂質分子空間分布和空泡孔洞結構(圖 4)。此基板可兼容印跡采樣和成像的功能,具有抗干擾能力強、靈敏度高等優點。該方法將質譜成像前處理流程縮短至10分鐘以內,更有利于與臨床醫學研究相結合。
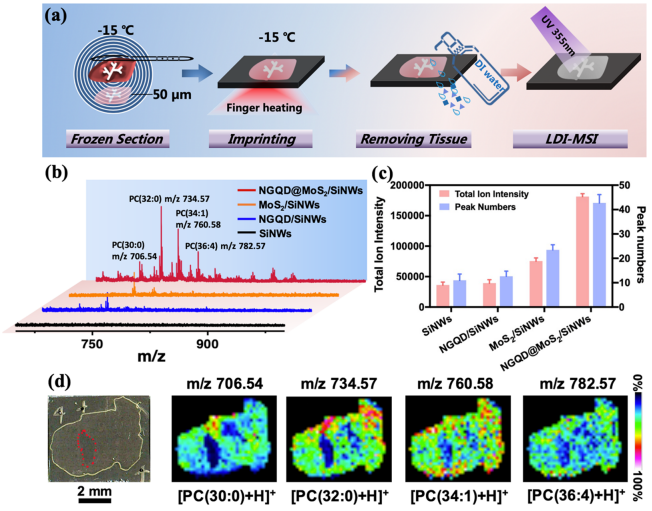
圖4. (a)印跡質譜成像流程;(b-c)不同基板獲得的成像效果對比;(c)小鼠肺組織質譜成像圖。
基于此項技術,研究人員對非小細胞肺癌(NSCLC)脂質代謝生物標志物進行了挖掘和可視化研究分析。通過對30例肺癌組織及相鄰正常組織進行脂質組學分析,發現了7個脂質分子可作為NSCLC的生物標志物。為了驗證這些生物標志物的可靠性,研究人員進行了受試者特性曲線(ROC)分析。結果顯示,單一的脂質分子作為標志物時的曲線下面積 (AUC)值范圍為 0.73-0.95(圖 5c)。通過7個脂質特征分子的標志物組組合所得AUC值 為 0.982(圖 5d),表明上述脂質分子構成的診斷Panel對NSCLC組織和相鄰組織具有極高的判別準確率。
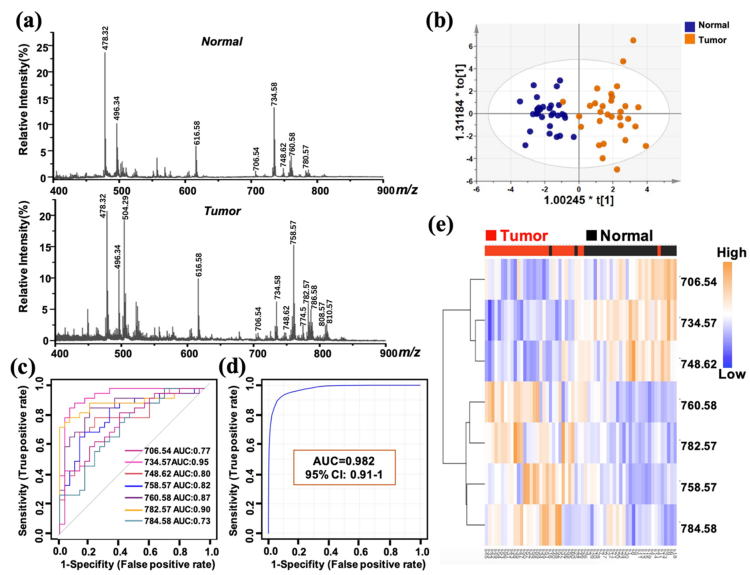
圖 5. (a)肺癌癌癥組織(Tumor)及其相鄰正常組織(Normal)成像后得到的平均譜圖;(b)OPLS-DA分數圖;(c)單一生物標志物ROC曲線及AUC值;(d)生物標志物組ROC曲線及AUC值;(e)層狀聚類圖。
質譜成像圖像在可清晰呈現上述7個特征脂質分子在腫瘤組織和相鄰正常組織的空間分布差異。這一結果顯示了TCSI-MSI在基于脂質組學的腫瘤組織診斷方面的獨特的優勢,有望推動脂質組學在精準醫學中的發展。
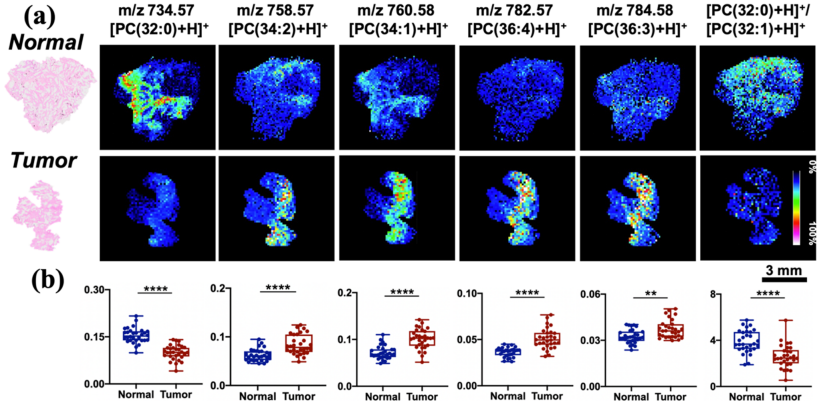
圖6. 肺癌癌癥組織(Tumor)及其相鄰正常組織(Normal)HE染色圖像及不同脂質分子的質譜成像圖。
論文的第一作者是化學系19級博士生劉星月。本論文采用的NGQD輔助液相剝離MoS2技術與浙江理工大學奚鳳娜(共同通訊作者)課題組合作;論文的臨床研究與附屬邵逸夫醫院何正富主任(共同通訊作者)和陳釗醫生(共同一作)合作。本課題的研究工作受國家自然科學基金(21874118)和杭州匯健科技有限公司的資助。
原文鏈接:https://pubs.acs.org/doi/full/10.1021/acsnano.2c02616

