

細胞是構成生命的基本單元,發展適用于活細胞的生物正交反應、并由此開發活細胞原位研究的化學技術已成為化學與生命科學交叉融合的研究前沿。生物正交反應是指可以在生命體系中進行、且不會與生命過程相互干擾的一類化學反應。生物正交反應為研究者對生命進程的研究帶來了革命性的技術,同時也為醫學研究、臨床診斷、新藥研發等提供了開創性方法,已成為化學生物學領域的核心方向之一。北京大學化學與分子工程學院陳鵬/樊新元課題組長期致力于活細胞化學反應的開發與應用研究,突破了在活細胞內研究蛋白質的技術瓶頸,開拓了生物正交反應和應用的新方向。近期,該實驗室進一步拓展活細胞化學反應的應用前沿與邊界,在細胞凋亡的生物正交調控、細胞相互作用的原位-實時捕獲以及新冠病毒表面的“共價反應”抗體等方向取得了系列進展。
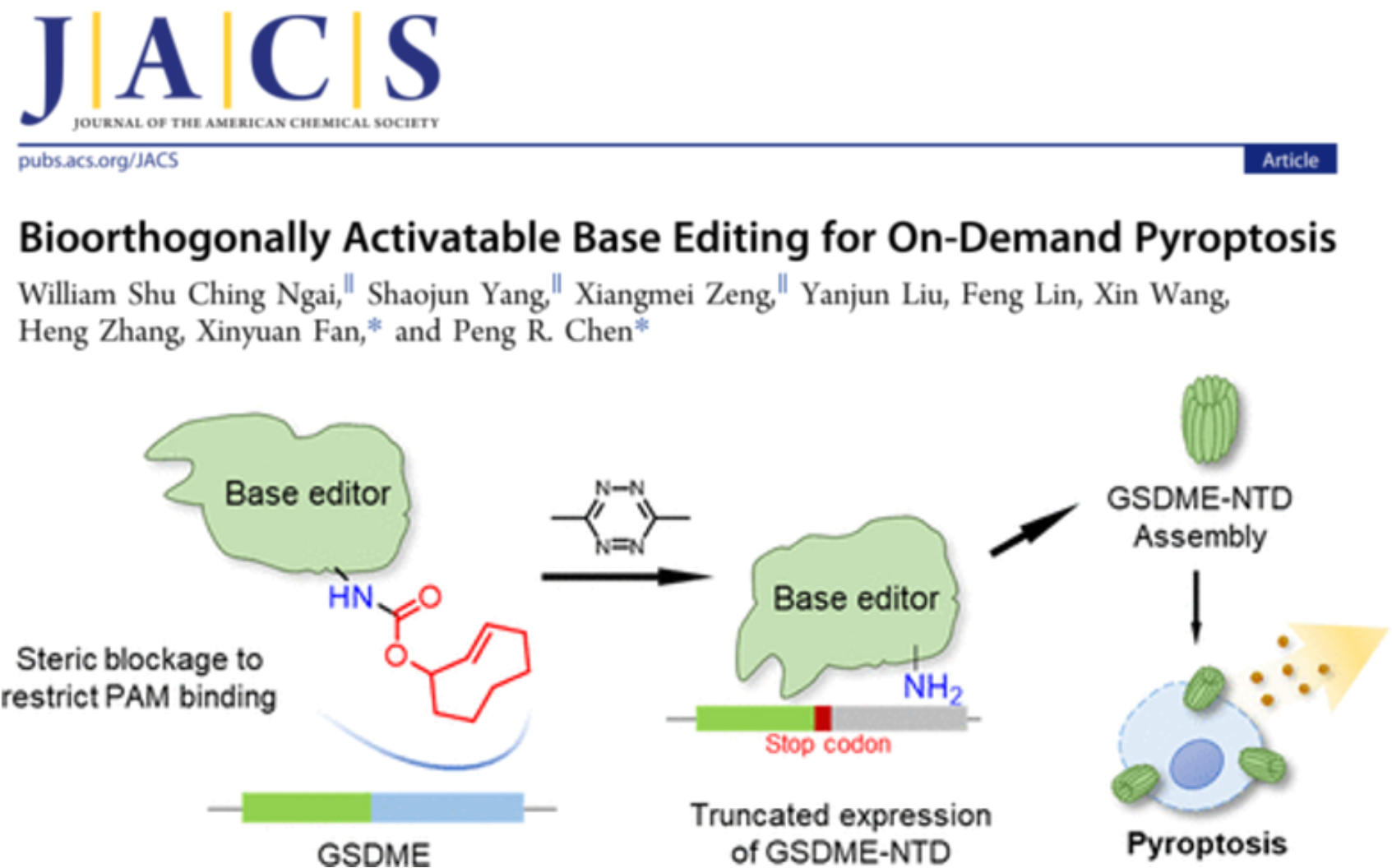
圖1. 基于生物正交脫籠反應的BaseBAC技術,可原位、實時觸發細胞焦亡 (J. Am. Chem. Soc. 2022, DOI: 10.1021/jacs.1c12924)
細胞焦亡是由gasdermin(GSDM)家族蛋白在經過蛋白酶剪切C端結構域后,其N端結構域釋放并在細胞膜上寡聚打孔而產生的一種細胞死亡方式。如何實現可控的細胞焦亡是進一步研究這一死亡類型的分子機制,拓展其在腫瘤等疾病治療領域應用的關鍵問題。然而,GSDM 的N端結構域具有很強的毒性,很難在細胞內直接表達和調控。近年來,研究人員通過在半催化失活的nCas9上融合胞嘧啶脫氨酶(APOBEC1),開發出了可以對目標堿基進行從C到T轉化的胞嘧啶堿基編輯器(CBE)。陳鵬/樊新元課題組報導了利用該堿基編輯器在開放閱讀框中實時引入終止密碼子的技術BaseBAC(圖1),可通過限制C端結構域的表達,實現目標蛋白質N端“截短體”的原位、實時表達,并激活細胞焦亡通路。這一基于生物正交剪切反應技術,依賴于其nCas9結構域識別PAM序列并進行底物序列的查驗。因此,作者在他們前期開發的蛋白質脫籠技術的基礎上,進一步將IEDDA生物正交剪切反應拓展到蛋白質和DNA結合的化學調控,通過調控dCas9與PAM序列結合來調控CBE引入終止密碼子,進而通過生成GSDME的N端蛋白觸發細胞焦亡。該體系在活細胞和活體小鼠中均展示出了優異的兼容性和調控能力。由于該技術針對Cas9與底物DNA的結合調控而開發,理論上適用于各種Cas9衍生的基因編輯工具,包括Adenosine Base Editor以及Prime Editor等。另一方面,細胞中含有多種在表達時為自抑制狀態的基因,其功能亦可以通過編程BaseBAC而進行原位、特異激活。此外,IEDDA反應具有良好的生物兼容性,使其能應用于多種生物學研究場景,具有廣闊的應用前景。
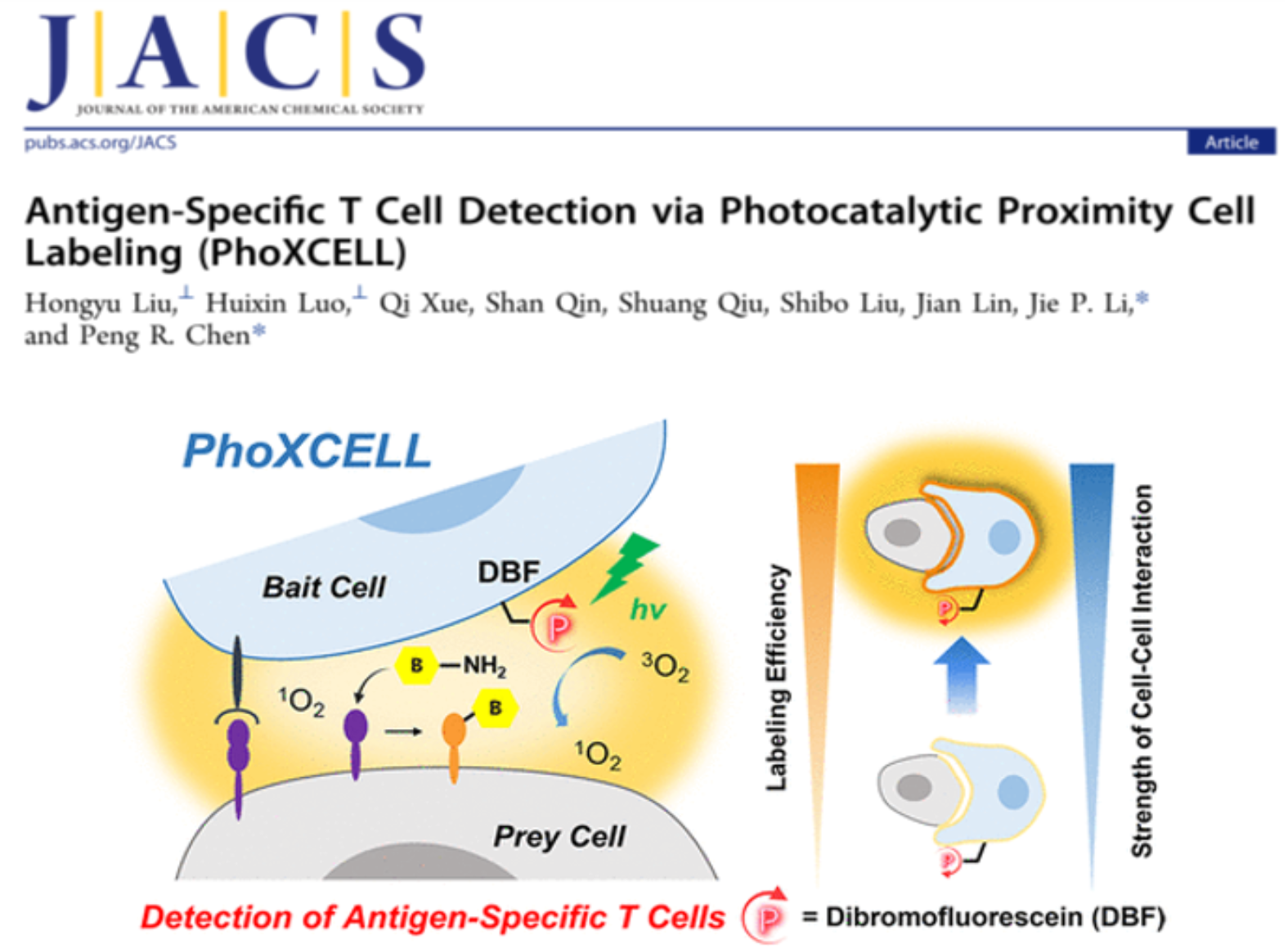
圖2. 基于生物正交光催化反應的PhoXCELL技術,可實現細胞-細胞相互作用的原位捕獲和定量鑒定(J. Am. Chem. Soc. 2022, DOI: 10.1021/jacs.2c00159)
細胞-細胞相互作用是生命過程中最基本的信息傳遞方式之一,尤其在免疫、神經等系統的生理過程中承擔著重要的角色。發展研究細胞-細胞相互作用的工具可以幫助免疫學家更好地研究免疫過程、調控細胞治療方法。然而,目前的工具都基于鄰近標記酶,缺乏時空可控性,且通常需要對免疫細胞(或小鼠)進行基因改造,技術門檻較高。此外,這些工具對細胞間相互作用的定量研究尚處于起步階段。陳鵬課題組與南京大學李劼課題組合作,發展了一種快速、高效鑒定細胞-細胞相互作用的定量工具PhoXCELL(Photocatalytic proXimity CELl Labeling, 圖2)。該技術基于光催化的小分子鄰近標記工具DBF(dibromofluorescein),通過光催化產生單線態氧觸發標記反應,可以在T細胞與樹突狀細胞(DC)的相互作用中,實現對抗原特異性T細胞的精確捕獲。具體來說,PhoXCELL可以時空特異地捕獲抗原特異性T細胞;同時,PhoXCELL還可以定量評價細胞-細胞間的相互作用,并能在腫瘤和癌旁淋巴結中同時捕獲腫瘤抗原特異性CD8+和CD4+ T細胞。作者利用PhoXCELL技術在小鼠三陰性乳腺癌模型E0771中捕獲腫瘤相關抗原特異性T細胞。通過將DBF展示在吞噬并遞呈有腫瘤抗原的DC上,成功的在腫瘤浸潤淋巴細胞和癌旁淋巴結中同時捕獲到了腫瘤抗原特異性CD8+和CD4+ T細胞。被捕獲到的細胞均高表達PD-1和CD39,且ELISPOT實驗進一步證明,這群細胞的確可以特異性識別腫瘤相關抗原。
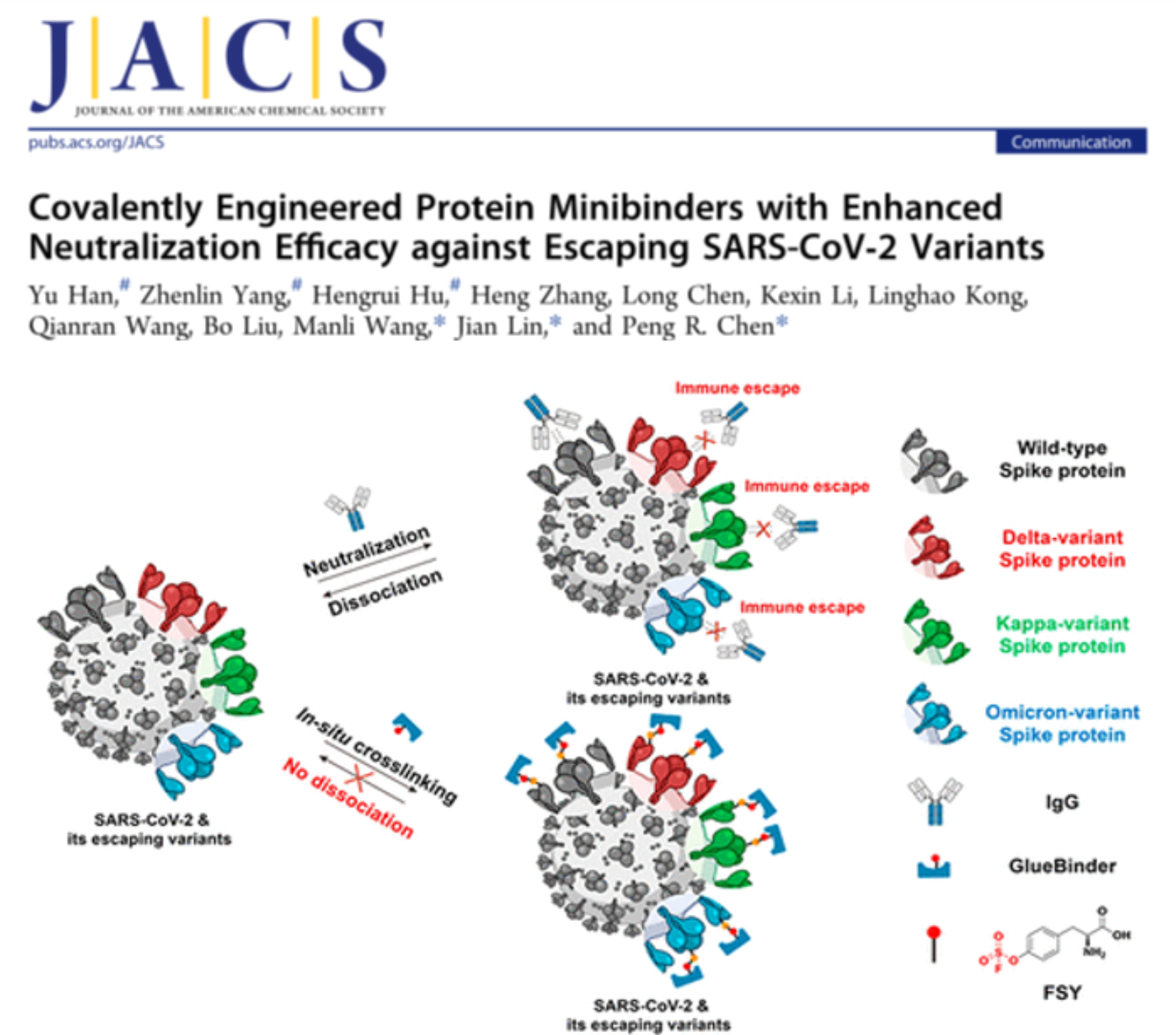
圖3. 基于鄰近化學交聯反應的GlueBinder技術,可用于防止新冠病毒突變產生的抗體逃逸 (J. Am. Chem. Soc. 2022, DOI: 10.1021/jacs.1c11554)
自2019年底新冠病毒疫情爆發以來,靶向新冠病毒受體結合域(RBD)并阻斷其與人體血管緊張素轉化酶2(ACE2)相互作用的中和抗體得到了廣泛關注與應用。但是新冠病毒的變異速度之快,使得逃逸突變不斷累積,眾多基于阻斷RBD-ACE2結合的中和抗體減弱或喪失了阻斷能力。因此,面對層出不窮的新冠病毒突變株,開發抵抗病毒逃逸的廣譜型中和試劑迫在眉睫。陳鵬/林堅團隊與中國科學院武漢病毒研究所王曼麗團隊合作,通過向抗體類“中和試劑”引入可進行“鄰近化學反應”的非天然氨基酸,實現了其與活病毒表面靶標蛋白的共價交聯反應,并展現了這一“共價化學”策略在抵抗新冠病毒突變逃逸方面的潛力。共價蛋白中和試劑(GlueBinder)與新冠病毒刺突S蛋白通過在結合界面原位發生的鄰近化學反應,將可逆的抗原-抗體結合轉化為不可逆的共價連接,實現了對野生型,Delta,Kappa以及Omicron等突變亞型RBD蛋白的交聯,最終恢復了蛋白中和試劑對Delta變體活病毒的中和能力(圖3)。體外競爭ELISA和活病毒中和實驗都證明GlueBinder對新冠病毒逃逸突變株具有更強的阻斷能力,這對恢復現有中和抗體的抗病毒作用具有借鑒意義。值得注意的是,共價改造策略針對全球大流行的Delta,Omicron等突變株都能夠保持高效交聯效果,體現了這一策略在抵抗病毒突變的通用性,為抗擊新冠病毒提供了新思路。
北京大學化學與分子工程學院博士生魏書程、楊紹軍、博士后曾祥梅;博士生劉宏宇、博士后羅惠新;博士生韓雨、楊振霖和中國科學院武漢病毒研究所博士生胡恒睿分別為上述論文的共同第一作者。該系列工作得到了國家自然科學基金委、科技部、北京分子科學國家研究中心、生物有機與分子工程教育部重點實驗室以及北大-清華生命科學聯合中心的資助。
原文鏈接:
https://pubs.acs.org/doi/10.1021/jacs.1c12924
https://pubs.acs.org/doi/10.1021/jacs.2c00159
https://pubs.acs.org/doi/10.1021/jacs.1c11554
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn