

光活化前藥可以在特定部位通過光激活藥物,實現治療藥物對腫瘤的時空可控性,從而降低藥物的毒副作用。近年來,光活化金屬前藥也有研究報道,例如基于鉑(IV)、釕(II)等的光活化前藥。現有報道的光活化金屬前藥主要通過光還原和光取代的方式破壞弱鍵(如Pt?O/N 和 Ru?N/S等),進而產生具有細胞毒性的活性分子,但這些弱鍵的存在不利于構建氧化還原活性高或親電性強的光活化金屬前藥。
近日,中山大學藥學院鄒滔滔教授課題組設計合成了一類穩定的靶向癌細胞的環金屬化金(III)烷基光活化前藥,這類前藥在光誘導下通過β-氫消除的方式斷裂較強的金-碳鍵,釋放金(III)氫化物(該課題組發展的第一個光激活金(III)前藥,見Angew. Chem. Int. Ed. 2020, 59, 11046-11052)。產生的金(III)氫化物在光照下與含硫醇(半胱氨酸)或硒醇(硒代半胱氨酸)結構的生物成分反應;同時,金(III)烷基配合物又可以作為光敏劑催化金(III)-硫/硒被過量的巰基化合物還原為金(Ⅰ)。
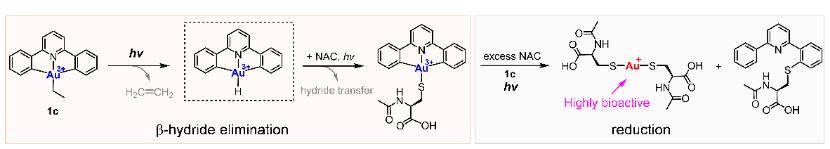
圖1. 烷基金(III)配合物發生光誘導的b-氫消除和還原反應
隨后對化合物進行結構修飾,構建藍光激活前藥;并通過引入葡萄糖片段,提高化合物的水溶性以及腫瘤細胞靶向性。進一步研究證明,修飾后的化合物在水溶液中可以自組裝成納米顆粒,并通過葡萄糖轉運蛋白介導的胞吞作用進入細胞,對癌細胞和正常細胞有較好的選擇性。
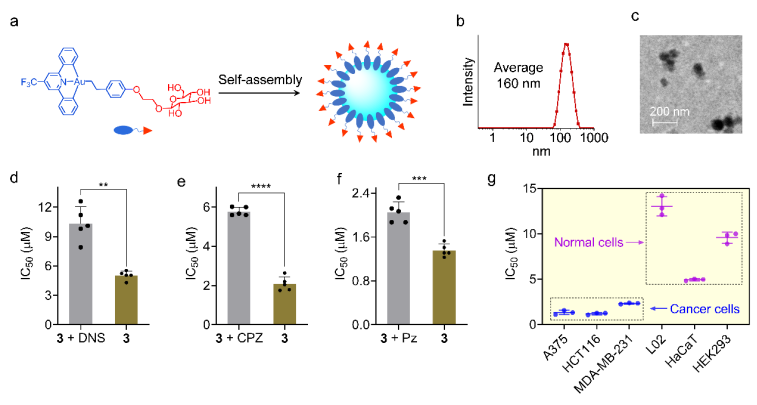
圖2. 葡萄糖官能化的金(III)配合物在水溶液中發生自組裝形成納米顆粒(a, b),發生葡萄糖轉運體GLUT介導的胞吞攝取(c),從而實現對癌細胞的選擇性(d)
在黑暗條件下,金(III)烷基前藥不具備抑制硫氧還蛋白還原酶的活性,但在光照條件下的抑制活性大大增強。細胞實驗表明,此類化合物基本沒有暗毒性,但光毒性比黑暗條件下提高達400倍以上,同時也能被800 nm雙光子激光激活產生毒性。體內實驗表明,金(III)前藥可以抑制斑馬魚血管生長,以及抑制小鼠體內惡性黑色素瘤的生長。
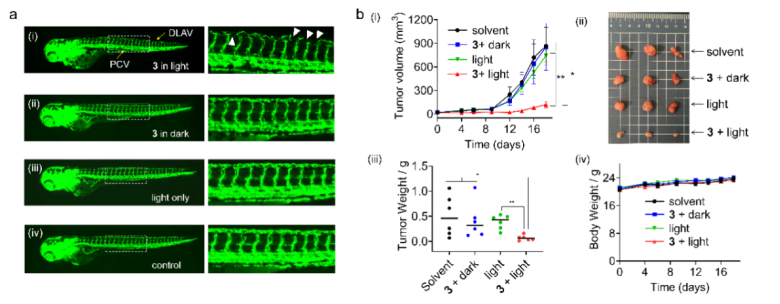
圖3. 光激活的金(III)配合物在斑馬魚中的抗血管生成作用(a)和在小鼠體內的抗癌活性(b)
該研究成果近日發表在《Angew. Chem. Int. Ed.》上(Jiang, J.#; Cao, B.#; Chen, Y.#; Luo, H.; Xue, J.; Xiong, X.; Zou, T.* Alkylgold(III) Complexes Undergo Unprecedented Photo‐Induced β‐Hydride Elimination and Reduction for Targeted Cancer Therapy. Angew. Chem. Int. Ed. 2022. e202201103)。中山大學藥學院博士研究生蔣佳、香港中文大學(深圳)曹蓓、中山大學藥學院碩士研究生陳玉婷為論文的共同第一作者,通訊作者為鄒滔滔教授,18級本科生薛佳穎也參與了相關研究。該工作得到了國家自然科學基金優秀青年基金、廣東省手性分子與藥物發現重點實驗室、廣東省珠江人才計劃青年拔尖人才、廣東省自然科學基金、廣州市科技計劃等項目支持。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202201103
參考資料:http://sps.sysu.edu.cn/article/11801
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn