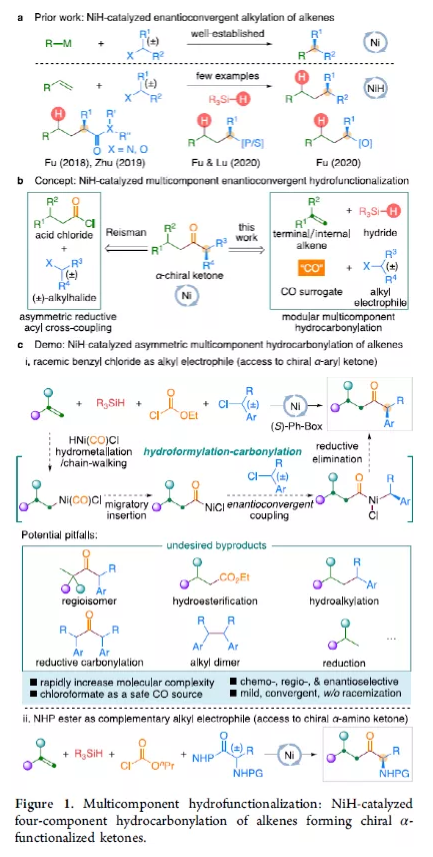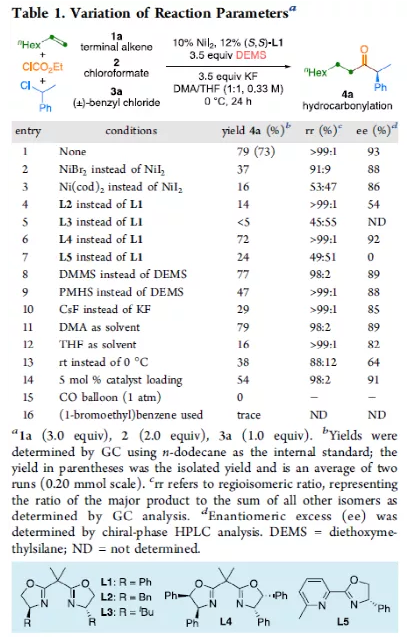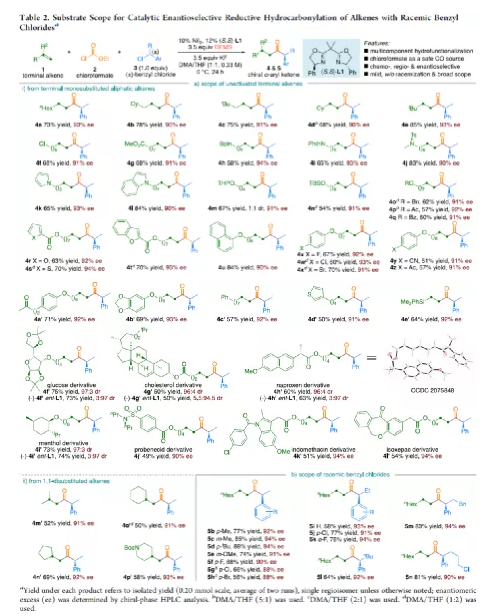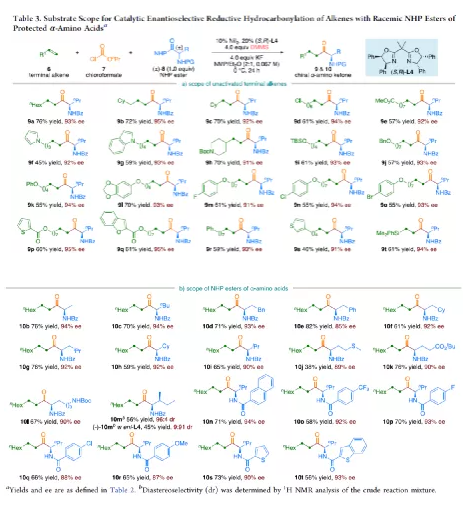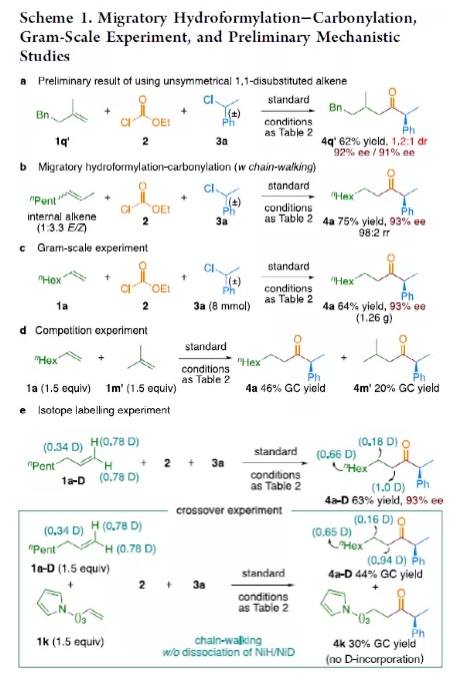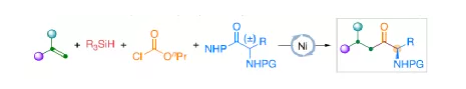
羰基化合物及其衍生物是許多天然產物和藥物中的重要結構骨架,同時也是合成復雜分子的重要中間體。過渡金屬催化的羰基化反應,作為一種具有吸引力且高效的合成方法,已廣泛用于學術界和工業界。然而,此類反應常存在使用貴金屬催化劑(例如Pd、Rh、Ru或Ir)或使用過量有毒且易燃的CO作為羰基源,從而限制了反應的應用。近年來,鎳作為廉價催化劑備受關注,尤其是涉及C(sp3)部分的羰基化反應中。為了避免在過量CO存在下形成失活的鎳/羰基配合物(如 Ni(CO)4),Gosmini和胡喜樂課題組通過將鋅還原劑和鈷或鎳催化劑相結合,可實現氯甲酸乙酯原位生成CO,從而作為CO安全有效的替代源。下載化學加APP,閱讀更有效率。金屬氫化物催化烯烴的加氫官能化是一種具有吸引力的策略,可避免有機金屬試劑的合成。在過去幾年中,通過鎳氫化物催化烯烴與外消旋烷基親電試劑的對映匯聚加氫烷基化反應,從而合成了一系列具有價值的官能團化C(sp3)立體中心(Figure 1a)。相比之下,由于反應性和選擇性難以同時控制,鎳氫化物催化烯烴分子間的多組分加氫官能團化在很大程度上仍未得到發展(Figure 1b, right)。2013年,Reisman課題組首次報道了鎳催化不對稱還原交叉偶聯反應,從而合成對映體富集的無環α,α-二取代酮衍生物(Figure 1b, left)。朱少林課題組設想,是否可通過原位生成的氫化鎳配合物參與連續的加氫甲酰化和羰基化反應,生成α-手性酮(Figure 1c)。首先,原位形成的氫化鎳羰基配合物[HNi(CO)LCl],將促進與烯烴的加氫金屬化/鏈行走反應,生成位阻較少的伯烷基鎳中間體。隨后,CO遷移插入,然后與外消旋仲烷基親電試劑,如芐基氯(Figure 1c, i)或受保護的α-氨基酸NHP酯(Figure 1c, ii),進行對映匯聚交叉偶聯,從而生成非對稱的含有α-官能化立體中心的二烷基酮。首先,作者以1-辛烯(1a)、氯甲酸乙酯(2)與(1-氯乙基)-苯(3a)作為模型底物,對還原性氫羰基化反應條件進行了篩選(Table 1)。篩選結果表明,當使用NiI2作為預催化劑,DEMS作為還原劑,(S,S)-苯基雙(噁唑啉)(Ph-Box)作為配體,KF作為堿,可獲得73%收率的產物4a,ee為93%。在獲得上述最佳反應條件之后,作者對底物范圍進行了擴展(Table 2)。首先,未活化的單取代和1,1-二取代末端烯烴均可順利反應,獲得相應的anti-Markovnikov氫羰基化產物4a-4l'和4m'-4p',收率為49-84%,ee為90-94%。值得注意的是,該反應具有良好的官能團耐受性,如酯基、鹵素、酮基、雜環取代基等,均與體系兼容。同時,通過對天然產物和藥物相關分子的后期功能化,如葡萄糖、膽固醇、萘普生、薄荷醇、丙磺舒、吲哚美辛、伊索克酸等衍生物,均可獲得相應的手性α-芳基酮衍生物4f'-4l',進一步證明了反應的實用性。此外,一系列外消旋芐基氯親電試劑,在標準條件下,也可順利反應,獲得相應的產物5b-5l,收率為56-88%,ee為88-94%。為了進一步證明該策略的通用性,作者通過易得的(±)-α-氨基酸合成N-羥基鄰苯二甲酰亞胺(NHP)酯(作為烷基化偶聯底物),通過對反應條件的優化后,可獲得一系列具有價值的對映體富集α-氨基酮衍生物(Table 3)。因此,作者又對底物范圍進行了擴展,一系列未活化的末端烯烴和NHP酯,在優化的條件下,均可順利反應,獲得相應的產物9a-9t和10b-10t,收率為38-82%,ee為85-95%。值得注意的是,該反應同樣具有良好的官能團耐受性,如烷基鹵、醚、芳基鹵、雜環取代基等,均與體系兼容。下載化學加APP,閱讀更有效率。最后,作者對反應的機理進行了研究(Scheme 1)。首先,當使用非對稱的1,1-二取代烯烴(1q')為底物,在標準條件下反應時,催化劑不能對烯烴取代基有效地區分,僅獲得dr為1.2:1的產物4q'(Scheme 1a)。當使用未活化的內烯烴(如2-辛烯的E/Z混合物)為底物,在標準條件下反應時,觀察到加氫金屬化、鏈行走、羰基化的過程(Scheme 1b)。其次,4a的克級實驗,同樣取得預期的結果(Scheme 1c)。同時,當使用等摩爾的1a和1m'進行了競爭實驗時,分別獲得相應的偶聯產物4a和4m',比例為2:1,從而表明空間位阻較小的單取代末端烯烴更具反應性(Scheme 1d)。此外,以氘代烯烴1a-D為底物,在標準條件下進行了同位素標記實驗中發現,即使是末端烯烴也會發生鏈行走的過程(Scheme 1e, top)。同時,由于未觀察到分子間氫氘置亂交叉產物,從而表明鏈行走的過程中NiH不會從烯烴中解離(Scheme 1e, bottom)。總結:南京大學朱少林教授課題組報道了一種鎳催化分子間的多組分還原加氫甲酰化-羰基化反應,涉及加氫金屬化、鏈行走、區域選擇性CO插入、對映匯聚烷基化等串聯過程。同時,該反應具有反應條件溫和、底物范圍廣泛、官能團耐受性高等特點。此外,通過該策略可合成一系列具有價值對映體富集的α-官能化酮衍生物,如手性α-芳基酮和α-氨基酮。