

近日,中國藥科大學工學院顧月清教授、李斯文副教授團隊在美國科學促進會(AAAS)出版的Science子刊Science Advances(IF=14.136)發表最新研究成果“A splenic-targeted versatile antigen courier: iPSC wrapped in coalescent erythrocyte-liposome as tumor nanovaccine”。中國藥科大學碩士研究生翟悅雯同學為本文第一作者,顧月清教授、李斯文副教授為本文的共同通訊作者。中國藥科大學為該論文唯一通訊單位。
腫瘤疫苗可通過刺激機體產生非特異性或特異性免疫攻擊腫瘤細胞和組織,是目前腫瘤免疫治療的研究熱點之一,但其廣譜性、靶向性與高效性有待進一步探究。誘導多能干細胞(iPSCs)有豐富的腫瘤相關抗原(TAA)表位庫,這表明基于iPSC的疫苗可以引起廣譜的抗腫瘤免疫反應。但完整的iPSCs具有致瘤性,注射入體內后容易被肺等組織截獲。因此,提取iPSC蛋白作為廣譜的腫瘤相關抗原有利于制備低致瘤性、高免疫原性的腫瘤疫苗。
脾是機體重要的免疫器官,TAA的脾靶向可以激發高效的抗腫瘤免疫反應。此外,作為人體的“血庫”,當血液被輸送到脾時,衰老或受損的紅細胞因失去變形能力會被脾攔截。因此,利用受損的紅細胞膜可實現脾靶向。但紅細胞膜的低載藥率限制了其應用。在此基礎上,課題組研究人員用能靶向結合抗原呈遞細胞(APCs)表面C型凝集素受體家族的甘露糖修飾脂質體“擴容”紅細胞膜,融合藥物載體不僅保留了紅細胞膜良好的生物相容性和靶向脾功能,而且克服了載藥缺陷,并刺激APCs成熟分化,促進抗原向下游T細胞的呈遞,開啟機體的特異性免疫的“開關”。
在這項研究中,研究人員開發了一種基于紅細胞膜與甘露糖脂質體融合并包裹iPSC蛋白的納米疫苗iPSC@RBC-Mlipo,結果顯示該納米疫苗在小鼠體內表現出明顯的脾蓄積,能激發特異性抗腫瘤免疫反應,并有效抑制多種腫瘤模型的生長、轉移和復發。因此,該納米疫苗在腫瘤預防和治療中具有臨床應用前景。
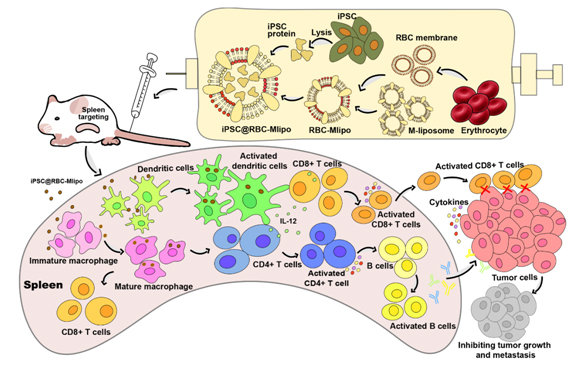
圖1 納米疫苗設計和體內免疫過程示意圖
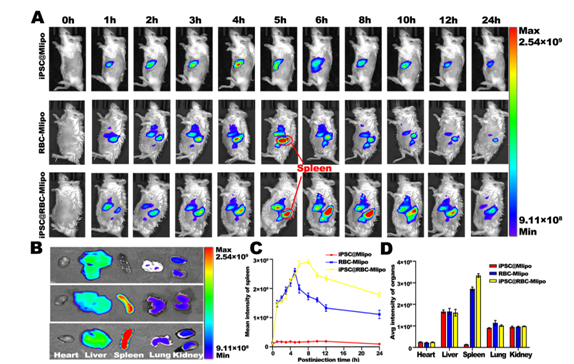
圖2 納米疫苗的脾靶向
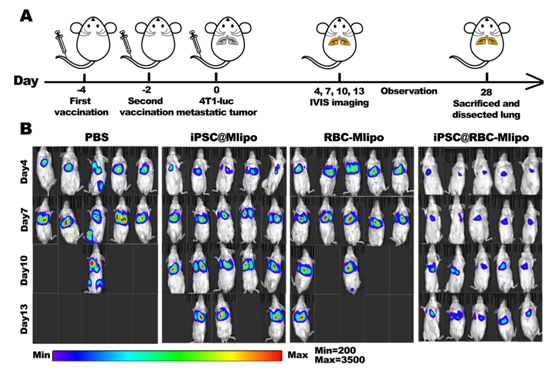
圖3 納米疫苗對腫瘤肺轉移的抑制作用
該研究得到了國家自然科學基金面上項目、江蘇省自然科學基金-優秀青年項目、江蘇省自然科學基金青年項目、國家自然科學基金-國家重大科研儀器研制項目等的資助。
文章鏈接:https://advances.sciencemag.org/content/7/35/eabi6326
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn