



惡性腫瘤是人類健康的重大威脅,而研究人員發(fā)現(xiàn)惡性腫瘤往往具有乏氧的特性。隨著乏氧程度的增加,惡性腫瘤的傳統(tǒng)化療與放療治療效果都將大打折扣。硝基還原酶(NTR)是實體瘤乏氧區(qū)域過度表達(dá)常見還原酶,開發(fā)硝基還原酶響應(yīng)的納米結(jié)構(gòu)在實體瘤的有效檢測與治療方面具有重大意義。針對這一重大需求,南開大學(xué)化學(xué)學(xué)院余志林課題組報道了一種具有NTR-響應(yīng)的非經(jīng)典氨基酸,可在腫瘤乏氧區(qū)域基于硝基還原有效調(diào)控多肽組裝,同時開啟納米結(jié)構(gòu)熒光特性,實現(xiàn)實體瘤乏氧區(qū)域的熒光成像檢測。該氨基酸在硝基還原作用下疏水的硝基轉(zhuǎn)化成親水氨基,促進(jìn)多肽從納米纖維結(jié)構(gòu)向納米顆粒轉(zhuǎn)變,同時抑制硝基咪唑?qū)晒饣鶊F的淬滅機制。基于多肽納米結(jié)構(gòu)的形貌轉(zhuǎn)變以及熒光恢復(fù),所制備的超分子熒光探針可對實體瘤乏氧區(qū)域高效富集-滲透成像。近期,該成果以“Noncanonical Amino Acids for Hypoxia-Responsive Peptide Self-Assembly and Fluorescence”為題,發(fā)表于J. Am. Chem. Soc.上(DOI: 10.1021/jacs.1c06435)。
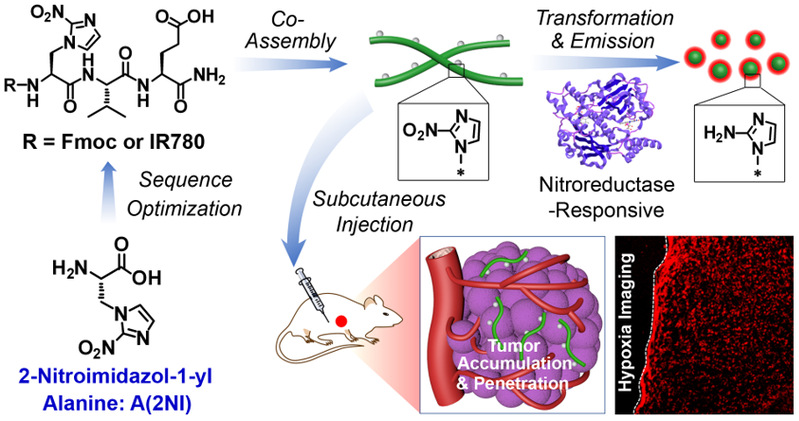
基于2-硝基咪唑丙氨酸(A(2NI))的多肽可控組裝及腫瘤熒光成像。圖片來源 J. Am. Chem. Soc.
多肽納米結(jié)構(gòu)特征與氨基酸序列具有極其重要的關(guān)系。基于氨基酸的刺激響應(yīng)反應(yīng)改變氨基酸序列、從而調(diào)控多肽組裝是實現(xiàn)多肽可控組裝的有效方法。在前期工作的基礎(chǔ)上(Nano Today 2021, 38, 101198;Chemical Science 2020, 11, 1383;Nano Letters 2019, 19, 7965),余志林課題組基于天然組氨酸及硝基咪唑基團的還原響應(yīng)特征,利用光延反應(yīng)合成了新型氨基酸2-硝基咪唑丙氨酸。通過優(yōu)化多肽序列,實現(xiàn)了硝基還原酶響應(yīng)性。結(jié)果表明多肽的N-端方向基團以及C-端負(fù)電荷殘基是硝基還原響應(yīng)性的必要結(jié)構(gòu)特征。并通過進(jìn)一步調(diào)控多肽疏水性,達(dá)到基于硝基還原的多肽納米結(jié)構(gòu)形貌轉(zhuǎn)變目標(biāo)。
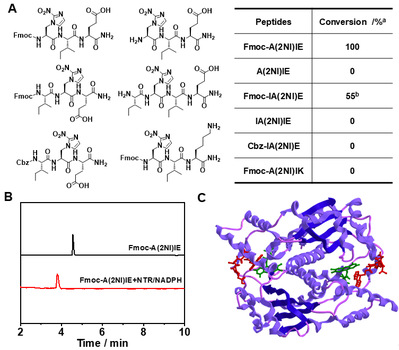
圖1. 含A(2NI)多肽分子的硝基還原酶響應(yīng)性。
基于2-硝基咪唑?qū)晒饣鶊F的熒光猝滅機制,對含該非天然氨基酸的多肽分子進(jìn)行熒光基團修飾,構(gòu)筑了一種乏氧響應(yīng)的超分子熒光探針。基于硝基還原酶調(diào)控的形貌轉(zhuǎn)變以及熒光恢復(fù),該探針在活體層面顯示良好的腫瘤富集和高效滲透能力,從而對乏氧區(qū)域腫瘤細(xì)胞有效成像。該新型氨基酸有望廣泛用于調(diào)控乏氧區(qū)域多肽和蛋白質(zhì)行為方面,從而拓展生物醫(yī)用功能材料的制備與開發(fā)。
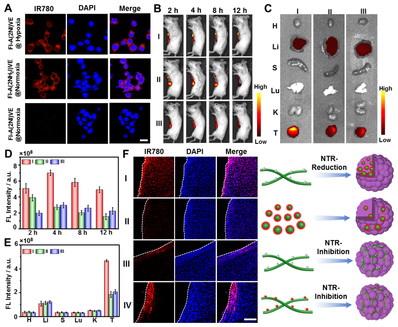
圖2 超分子納米探針對乏氧條件下的細(xì)胞及活體內(nèi)實體瘤成像結(jié)果。圖片來源 J. Am. Chem. Soc.
論文得到了國家自然科學(xué)基金委及中央高校基礎(chǔ)科研經(jīng)費支持。論文第一作者是南開大學(xué)博士研究生胡彬彬,通訊作者為南開大學(xué)化學(xué)學(xué)院余志林研究員。
論文連接:https://pubs.acs.org/doi/10.1021/jacs.1c06435
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn