

(圖片來源:Nat. Commun.)
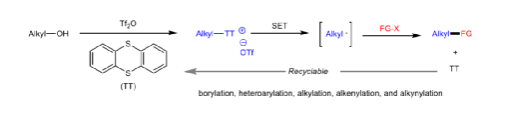
锍鹽是有機化學中用途最廣泛中間體之一,其反應性取決于硫原子的正電荷。同時,許多锍鹽試劑已被用于親電取代反應。迄今為止,已知酶催化锍鹽產生烷基自由基的酶都屬于自由基S-腺苷甲硫氨酸(SAM)家族(Fig. 1a)。在過去幾十年,利用锍鹽作為自由基前體的一般方法已被研究。最近,光氧化還原催化策略備受關注,可在溫和條件下實現單電子轉移(SET)。2019年,Ritter等報道了芳烴的位點選擇性C-H官能團化以構建S-(芳基)噻蒽鹽,可在光氧化還原催化條件下進行相關的自由基反應(Fig. 1b)。Procter等還報道了一種通過有機光氧化還原催化劑構建(雜)聯芳基化合物的一鍋策略,涉及S-(芳基)二苯并噻吩鹽的生成。盡管已取得一定的進展,但絕大多數僅限于形成芳基自由基,對于烷基自由基生成則很少被研究。此外,作為S-葉立德的前體,S-(烷基)锍鹽已廣泛應用于環化和重排反應。早期,Kellogg等研究光氧化還原催化條件下S-(烷基)锍鹽的還原反應。然而,到目前為止,對于穩定烷基自由基的生成方面受到限制。在此,作者報道了一種通過S-(烷基)噻蒽鹽生成各種不穩定的烷基自由基(關鍵中間體),隨后在溫和的光氧化還原條件下進行各種轉化(Fig. 1c)。同時,形成的噻蒽(TT)試劑在反應后可循環使用。下載化學加APP,閱讀更有效率。
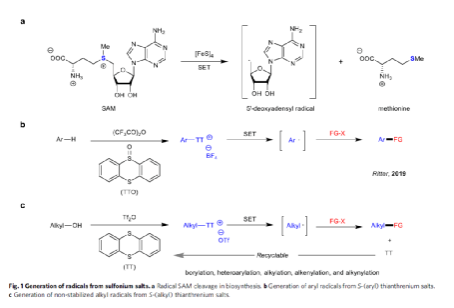
對于S-(烷基)噻蒽鹽1a,可通過應的醇1和TT試劑進行克級規模的合成(Fig. 2)。
(圖片來源:Nat. Commun.)
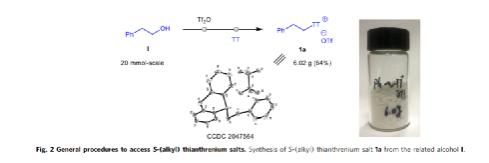
烷基硼酸酯是有機合成中的重要組成部分,傳統合成方法涉及有機鋰或格氏試劑的親電硼化和烯烴的硼氫化反應。最近,也實現了利用烷基自由基前體進行此類化合物的合成。在此,作者在光/熱誘導條件下進行噻蒽鹽的脫硫硼化反應,從而合成烷基硼酸酯(Fig. 3)。首先,在藍色LED照射下,1a可與B2cat2反應得到中間體1b,再與頻哪醇反應,以82%的總收率獲得穩定的硼酸酯1c,但對于锍鹽(如1a'、1a''和1a''')反應效果均較差。其次,史壯志課題組近期還開發了一種Lewis堿(B1)促進的Katritzky鹽的脫氨基硼化反應,僅需在80 ℃下反應,即可以75%的收率獲得產物1c,但對于其它的Lewis堿(如B2和B3)則具有較低的反應性。
(圖片來源:Nat. Commun.)
在獲得上述最佳反應條件之后,作者開始對噻蒽鹽的底物范圍進行了擴展(Fig. 4)。一系列伯烷基取代的底物,均以高收率獲得相應的產物2c-19c。值得注意的是,含有鹵化物、烯烴、炔烴等活性基團的底物均可兼容。同樣,仲烷基取代的底物在標準條件下也可順利反應,獲得產物20c-24c。對于芐基取代的噻蒽鹽(25a)在光誘導條件下可與體系兼容,但在熱誘導條件下僅觀察到痕量產物25c。含有全氟烷基鏈的噻蒽鹽26a也易進行硼化反應,獲得所需產物26c。對于具有三個順式雙鍵的α-亞麻酸噻蒽鹽(27a)在反應過程中,構型均保持不變。此外,該策略也用用于復雜分子的后期修飾,如28c-30c。對于含有兩個锍鹽單元的底物31a,可在標準條件下進行雙硼化反應。值得注意的是,在上面的大多數例子中,光化學策略比Lewis堿策略具有更好的反應性。對于芳基上具有C-I鍵的噻蒽鹽(32a),在熱反應條件具有優異的化學選擇性,但在光化學條件下則具有較差的選擇性。
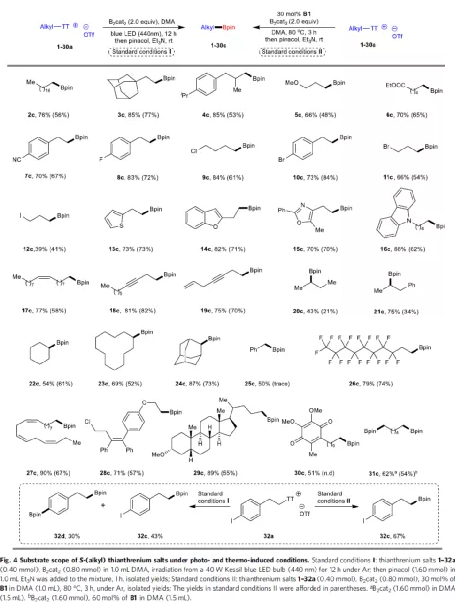
(圖片來源:Nat. Commun.)
隨后,作者對反應的實用性進行了研究(Fig. 5)。首先,1a在標準條件下反應時,可獲得82%收率的產物1c,并實現TT試劑的回收利用。其次,醇化物I通過一鍋磺化、硫蒽化、硼化反應,以67%的收率生成烷基硼酸酯1c。此外,化合物34(含有醛基和氯基)也可通過一鍋法合成相應化合物35。
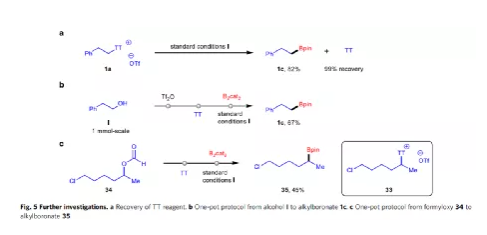
(圖片來源:Nat. Commun.)
此外,作者還對反應機理進行了研究(Fig. 6)。首先,通過對噻蒽鹽1a、Katritzky鹽II和NHPI酯III的CV對比發現,噻蒽鹽1a具有不可逆的還原曲線,且比II和III更易還原。其次,通過對比1a、B2cat2以及1a和B2cat2的混合吸收光譜發現,混合物的紅移證明了電子供體配合物的存在。此外,在可見光照射下,在1a的反應體系中加入TEMPO或1,1-二苯基乙烯作為自由基清除劑時,獲得少量的產物36和37。噻蒽鹽38的脫硫硼化可形成主產物39以及環化產物40。上述這些結果表明,反應涉及烷基自由基的形成。下載化學加APP,閱讀更有效率。
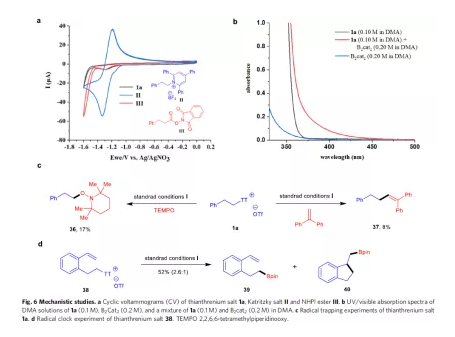
(圖片來源:Nat. Commun.)
最后,作者提出了一種可能的反應機理(Fig. 7)。首先,S-(烷基)噻蒽鹽和B2cat2·DMA反應生成EDA配合物A,在可見光照射下進行單電子轉移,形成烷基自由基B、DMA·Bcat加合物C和TT。隨后,烷基自由基B與B2cat2·DMA加合物反應,生成自由基配合物E。最后,通過B-B鍵的斷裂形成硼化產物b和硼基自由基D,可進一步還原底物a以形成DMA·Bcat加合物C并再生烷基自由基B。
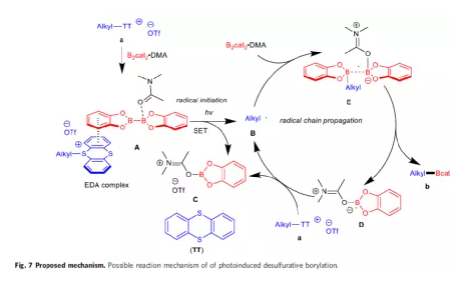
(圖片來源:Nat. Commun.)
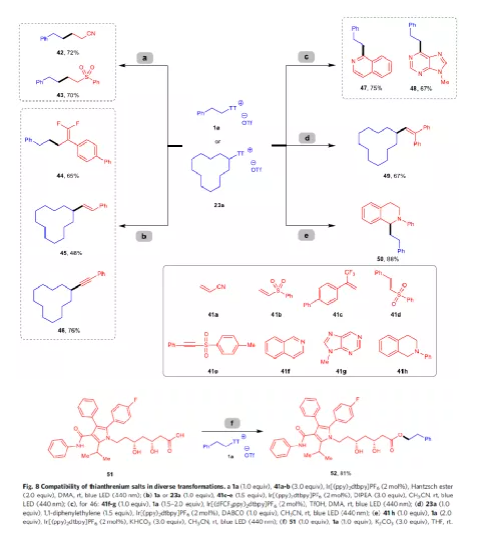
同時,噻蒽鹽也可在光氧化還原催化條件下進行各種偶聯反應(Fig. 8)。首先,噻蒽鹽1a可與缺電子烯烴41a和41b進行Giese自由基加成反應,得到產物42-43。噻蒽鹽1a可與α-三氟甲基烯烴41c進行脫氟烷基化反應,獲得65%收率的偕二氟烯烴44。同時,噻蒽鹽23a也可進行烯基化和炔基化反應,獲得產物45和46。其次,異喹啉和嘌呤衍生物也可與1a進行光氧化還原Minisci型官能團化反應,獲得烷基化產物47-48。噻蒽鹽23a也可與1,1-二苯基乙烯反應,獲得67%收率的產物49。對于N-芳基四氫異喹啉中的C(sp3)-H鍵也可與1a進行偶聯反應,獲得產物50。此外,S-(烷基)噻蒽鹽還可作為親電試劑,為親核試劑提供烷基源,如噻蒽鹽1a與阿托伐他汀反應(51)時,具有優異選擇性,獲得酯化產物52。
(圖片來源:Nat. Commun.)
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn