

(圖片來源:J. Am. Chem. Soc.)
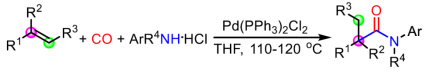
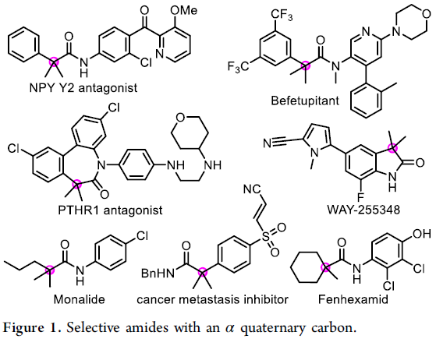
加氫羰基化反應,作為合成羰基化合物的一種高效策略,具有高原子經濟性,但對于區域選擇性的控制則極具難度。對于文獻中使用Co、Ni、Fe和Ru配合物的催化體系中,存在反應活性低、底物范圍窄以及伴隨著氨基甲酰化副反應等弊端。最近,Beller、Cole-Hamilton、Huang和Alper等實現了Pd催化烯烴的反馬氏加氫氨基羰基化反應,合成一系列線性酰胺。然而,由于空間位阻的影響,過渡金屬催化烯烴的馬氏加氫氨基羰基化反應并不理想(Scheme 1A),僅報道關于通過單取代烯烴合成α-叔碳中心的酰胺化合物(Scheme 1B)。相反,對于1,1-二取代或1,1,2-三取代烯烴的馬氏加氫氨基羰基化反應尚未被研究,可能存在以下挑戰:(i)1,1-二取代烯烴對過渡金屬氫化物的結合親和力很低,所得的叔烷基金屬中間體非常不穩定,易進行β-氫消除;(ii)將CO遷移到空間受阻更大的叔烷基金屬鍵中非常困難;(iii)由于鄰位的空間位阻很大,酰基金屬中間體的氨解反應會很緩慢。此外,具有α-季碳中心的酰胺化合物,廣泛存在于生物活性分子、藥物、農藥、功能材料等中,如各類抑制劑、除草劑等(Figure 1)。在此,西北大學關正輝課題組報道了一種新型且高效的Pd催化苯胺鹽酸鹽與1,1-二取代或1,1,2-三取代烯烴的馬氏加氫氨基羰基化反應,從而合成一系列具有α-季碳中心的酰胺化合物(Scheme 1C)。

(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
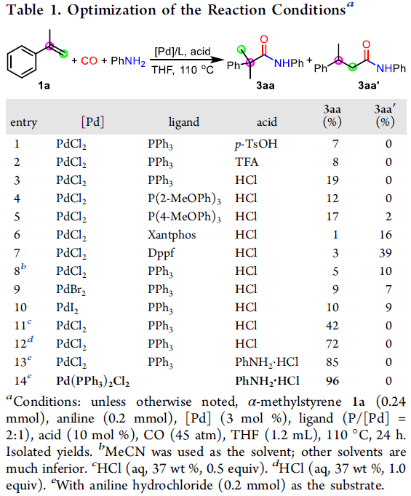
首先,作者以α-甲基苯乙烯1a、苯胺和CO作為模型底物,進行了大量條件的篩選(Table 1)。篩選結果表明,以3 mol %的Pd(PPh3)2Cl2為催化劑,苯胺鹽酸鹽為底物,在THF溶劑中110 ℃反應,可以96 %的收率獲得酰胺產物3aa,b/l > 99:1。
(圖片來源:J. Am. Chem. Soc.)
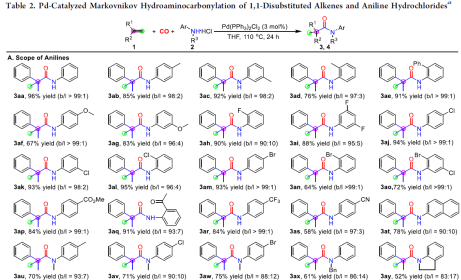
在獲得上述最佳反應條件后,作者開始對底物范圍進行了擴展(Table 2)。首先,苯胺的芳基取代不受電子效應和定位效應的影響,均以中等以上的收率獲得相應產物3aa-3as。對于2-萘胺鹽酸鹽和二級苯胺,也與體系兼容,獲得產物3at-3ay。其次,對于1,1-二取代烯烴底物中的芳基取代,同樣不受電子效應和定位效應的影響,均可獲得相應的產物3ba-3pa。對于2-萘基和2-噻吩基取代的烯烴,1-亞甲基-2,3-二氫茚和α-丙基苯乙烯,均以中等以上的收率獲得相應產物3qa-3ta。對于甲基丙烯酸酯和未活化脂肪族1,1-二取代的烯烴,也與體系兼容,獲得產物3ua-3xa。此外,通過對一些的生物活性分子的后期修飾(如4a-4d),進一步證明了反應的實用性。
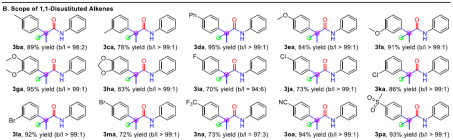

(圖片來源:J. Am. Chem. Soc.)
隨后,作者對1,1,2-三取代烯烴的范圍進行了擴展(Table 3)。通過進一步條件的優化(延長反應時間),具有一個芳基和兩個甲基取代基的三取代烯烴,以中等至良好的收率獲得酰胺5a-5g。同時,1-亞乙基-2,3-二氫茚以及具有兩個烷基和一個酯基或三個烷基的三取代烯烴,也與體系兼容,獲得產物5i-5l。
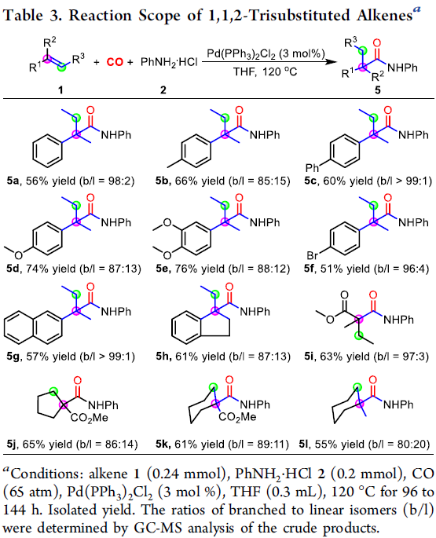
(圖片來源:J. Am. Chem. Soc.)
為了進一步證明反應的實用性,作者對相關藥物進行了合成(Scheme 2)。在上述標準條件下,僅需一步即可合成殺真菌劑環酰菌胺(6a)、農用除草劑庚酰草胺(6b)、PTHR1拮抗劑的關鍵合成中間體(6c)以及吲哚利旦(強心藥)、極光激酶抑制劑AKI-001、雄激素受體拮抗劑等關鍵中間體(6d)。
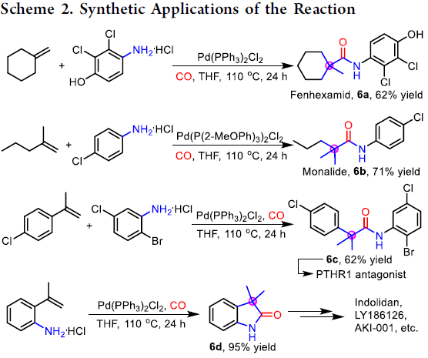
(圖片來源:J. Am. Chem. Soc.)
為了進一步了解反應的機理,作者進行了相關的對照實驗(Scheme 3)。首先,化合物7與苯胺在Pd(PPh3)4催化下,未能獲得產物3aa。其次,在無鈀催化劑時,化合物1a與苯胺鹽酸鹽也未發生反應。同時,化合物1a也不可與苯基氨基甲酰氯8反應。這些結果表明,加氫氨基羰基化反應最有可能通過鈀氫途徑進行。
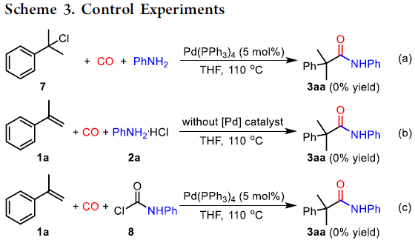
(圖片來源:J. Am. Chem. Soc.)
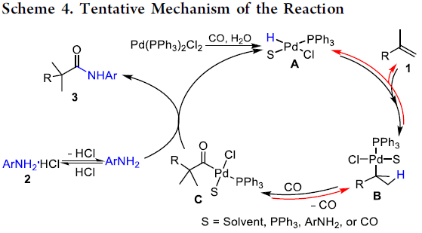
根據上述的實驗和相關文獻的查閱,作者提出了一種可能的反應機理(Scheme 4)。首先,由Pd(PPh3)2Cl2與CO和痕量H2O反應,生成活性的鈀氫催化劑A。其次,1,1-二取代烯烴1與鈀氫催化劑A進行配位和插入,形成叔烷基鈀中間體B。隨后,將CO配位并插入叔烷基鈀中間體B中,獲得酰基鈀中間體C。最后,中間體C通過氨解形成酰胺3,并再生鈀氫催化劑A。
(圖片來源:J. Am. Chem. Soc.)
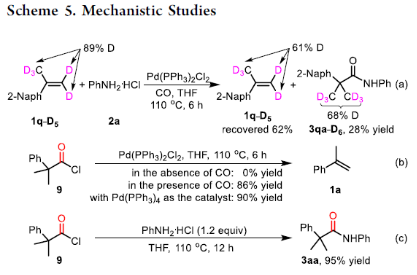
此外,作者還對上述的機理進行了進一步的研究(Scheme 5)。首先,當1q-D5(89% D)與2a在標準條件下反應6 h后,獲得28%收率的3qa-D6(甲基含有68% D),并且在回收的1q-D5中觀察到明顯的H/D交換。這些結果表明,從鈀氫A到烷基鈀B的加氫鈀化過程是可逆的。同時,在無苯胺鹽酸鹽2a時,2-甲基-2-苯基丙酰氯9可進行脫羰獲得產物1a,而化合物9可與2a直接反應,獲得95%收率的酰胺3aa。這些結果表明,在CO存在下,Pd(II)可被還原為Pd(0),同時CO從烷基鈀B到酰基鈀C的插入步驟也是可逆的。
(圖片來源:J. Am. Chem. Soc.)
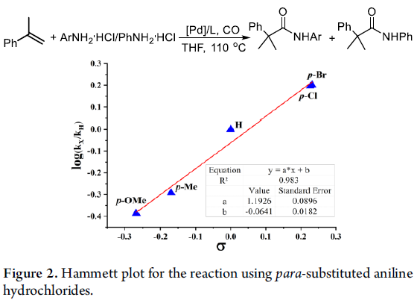
同時,作者還研究了苯胺基取代基對反應速率的影響(Figure 2)。反應結果表明,氨解可能是反應的限速步驟。
(圖片來源:J. Am. Chem. Soc.)
總結:西北大學關正輝課題組報道了一種新型、簡便且高效的鈀催化1,1-二取代或1,1,2-三取代烯烴與苯胺鹽酸鹽的馬氏加氫氨基羰基化反應,從而合成一系列具有α-季碳中心的酰胺化合物。同時,該反應具有原料易得、官能團耐受性高、底物范圍廣等特點。此外,機理研究表明反應通過鈀氫途徑,并且加氫鈀化和CO插入是可逆的,氨解可能是限速步驟。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn