

乙型肝炎病毒(HBV)感染是影響全球的公共衛生問題之一。全世界約有 2.9 億人口罹患慢性乙肝感染, 每年約 78 萬人死于乙肝引起的肝臟疾病或者肝癌。丁肝病毒(HDV)作為乙肝病毒的衛星病毒,只有在乙肝病毒存在的情況下才可以復制。乙肝病毒和丁肝病毒的共感染往往會導致更為嚴重的臨床癥狀,并有更高的概率發展至肝硬化或者肝癌。李文輝實驗室于2012年首次發現牛磺膽酸鈉共轉運多肽(NTCP)為乙肝病毒和丁肝病毒進入肝臟細胞的功能性受體,為乙肝感染和丁肝感染的預防和治療打開了新的大門,基于此研究成果而開發的穩定表達人NTCP的HepG2細胞系(HepG2-NTCP細胞)提供了便捷有效的乙肝病毒和丁肝病毒體外感染模型,為研發靶向NTCP從而抑制乙肝/丁肝感染的藥物提供了有力平臺。
自從乙肝受體發現以來,基于靶向NTCP的藥物發現有了突破性進展。特別是今年由德國MYR GmbH公司研發的世界首個NTCP抑制劑-Myrcludex B在歐洲作為用于治療慢性丁肝感染的藥物獲得上市批準,為NTCP作為具有臨床價值的全新藥物靶點提供了有力支持。然而Myrcludex B是一種源自HBV Pre-S1多肽的大分子藥物,口服利用度低,僅限于靜脈內或皮下給藥,且價格昂貴。因此,針對 NTCP 的小分子抑制劑有極大的應用前景,研發價值和市場潛力。
宿主-病原體感染或者蛋白與蛋白等生物大分子之間的相互作用多為多價多位點強相互作用,而與生物大分子相互作用的小分子一般都是相對低親和力并且與單個受體結合位點的單價模式,所以通過小分子靶向這類多價結合的大分子是最具挑戰性的策略。為了提高小分子調控功效,設計多位點協同相互作用的多價小分子是一種潛在的解決方案,如HCV非結構蛋白5A(NS5A)抑制劑和通過抑制IAP激活cytochrome c依賴的細胞凋亡的雙價Smac模擬小分子等。然而并不是所有的小分子構建成多價分子,與大分子的結合能力都會增強,多價小分子的核心單體骨架結構,單體分子連接方式,甚至是整體分子構型和剛性等都會影響多價分子的綜合結合強度。除了設計多價分子的協同效果增強結合活性以外還需要全面考量和評價多價分子的成藥性并進行生物利用度等優化,因為大部分這類藥物分子設計都超出傳統藥化經驗規則。
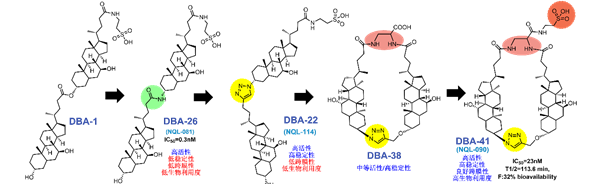
該研究中,作者偶然發現了熊去氧膽酸(TUDCA)聚合而成的二聚膽酸衍生物(DBAD)具有高效抑制NTCP功能的活性,而不同連接形式的二聚體產生的抑制效果顯著不同。基于具有活性的二聚體結合模式,作者進一步設計并合成了上百種不同鏈接方式,不同骨架和不同構型的二聚膽酸分子。通過進行抑制乙肝病毒感染實驗,作者對這些化合物進行了詳細的結構-活性關系(SAR)研究,發現了具有高活性和高持續性抑制NTCP功能的膽酸二聚體。此外,該研究還發現NTCP氨基酸序列157–165片段可能與二聚膽酸的結合有關,并造成了二聚膽酸對于不同種屬NTCP抑制能力上的差異。研究團隊接下來通過優化[AB-MPS]數值,針對性地構建優勢環系骨架,剛性構型和優勢官能團等策略,對二聚膽酸衍生物進行了深入的成藥性優化。并最終得到了對人NTCP具有高度選擇性,高親和力和優良生物利用度的強效化合物DBA-41(NQL-90)。對其在人NTCP敲入小鼠中的體內功效研究中表明,DBA-41能夠影響人NTCP敲入小鼠體內的膽酸水平,但在給藥過程中小鼠的丙氨酸轉氨酶(ALT)水平或體重均未觀察到差異。這些結果證明了DBA-41在抑制NTCP底物攝取方面的體內功效,同時顯示出良好的安全性,具有被開發為HBV感染抑制劑的潛力。
綜上,齊湘兵實驗室與李文輝實驗室合作開發了一類抑制乙肝受體NTCP的高活性高選擇性的膽酸二聚體小分子,詳細的藥化研究最終得到一類高生物利用度并且具有臨床開發潛力的藥物分子。該類小分子藥物設計是通過多價結合模式抑制NTCP活性的第一個實例,其中許多具有出色的抑制活性和優良的物種選擇性。全面的藥化研究特別是成藥性優化策略為抑制NTCP介導的HBV病毒進入和底物轉運提供了新的藥物開發設計策略,也可以用作描述NTCP介導的病毒進入和底物轉運的分子機制的有用工具。
李文輝實驗室博士生劉陽,嚴歡和齊湘兵實驗室博士生張磊,王志強對本工作有重要貢獻,其他作者包括吳青翠,宋瀟,孫國梁, 周忠敏, 彭博, 嚴麗蔚等。該研究由科技部973項目、北京市科委、清華大學等資助,在北京生命科學研究所完成。
全文鏈接:https://pubs.acs.org/doi/full/10.1021/acs.jmedchem.1c00078
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn