

干擾素基因刺激蛋白STING(Stimulator of Interferon Gene)是錨定在內質網上感受外源DNA入侵的重要銜接蛋白,通過靶向STING激活cGAS-STING信號通路誘導抗腫瘤天然免疫,已成為繼PD-1/PD-L1等免疫檢查點抑制劑之后的免疫治療“未來之星”。 STING與其配體cGAMP的結合可促進STING二聚或寡聚,進而募集絲氨酸/蘇氨酸蛋白激酶(TBK1),磷酸化干擾素調節轉錄因子IRF3,誘導I型干擾素(IFN)及諸多促炎細胞因子的產生,最終激活細胞毒CD8 T細胞來促進適應性免疫應答。當前,STING調節劑已成為針對癌癥及自身免疫性疾病等多種疾病的重要免疫治療新策略,但STING作為藥物靶標的成藥性及其相關調節劑研究目前面臨困境和挑戰。
近日,上海交通大學藥學院張翱課題組及其在中科院上海藥物研究所的研究組對cGAS-STING信號通路中具有重要生物功能的關鍵蛋白(cGAS、STING、TBK1、ENPP1)的成藥前景、研究進展及存在的挑戰進行了系統的總結,并提出了發展方向以及亟須解決的關鍵科學問題。
隨后,課題組與上海藥物研究所抗腫瘤藥理研究團隊緊密合作,基于已報道的氨基苯并咪唑二聚體類STING激動劑具有獨特結構和高親和力,但具有潛在毒性等特點,通過對該類化合物的幾個熱點結構位點(hotspots))進行了系統的漸進式結構優化,得到了新型三唑類衍生物。該類化合物對STING信號通路具有較強的激活能力,而敲除STING則活性喪失。新化合物能同時激活人源和鼠源STING,且對多種人源STING蛋白突變體均有激活作用,適用性廣,活性強度較為理想。該化合物藥代動力學性質較好,其水溶性比Nature雜志報道的氨基苯并咪唑二聚體STING激動劑高20倍以上。在免疫健全的小鼠乳腺癌和結腸癌腫瘤模型中,該三唑化合物的瘤內注射和靜脈給藥均具有顯著的抗腫瘤效應,耐受性也較好,有一定的轉化前景。
這些工作最近先后發表在國際知名學術期刊Acta Pharm Sin B(2020, 10, 2272-2298.)以及J Med Chem (2021, 64, 1649-1669.)。論文的第一作者分別是張翱課題組研究員丁春勇、聯培博士生宋子蘭以及上海藥物所抗腫瘤藥理研究團隊研究人員王璽淵和張燕,通訊作者分別為張翱教授和謝作權副研究員。該工作受到上海交通大學“雙一流”學科建設項目、重點前瞻布局基金以及中科院個性化藥物先導專項和國家科技重大專項“新藥創制專項”等項目的支持。
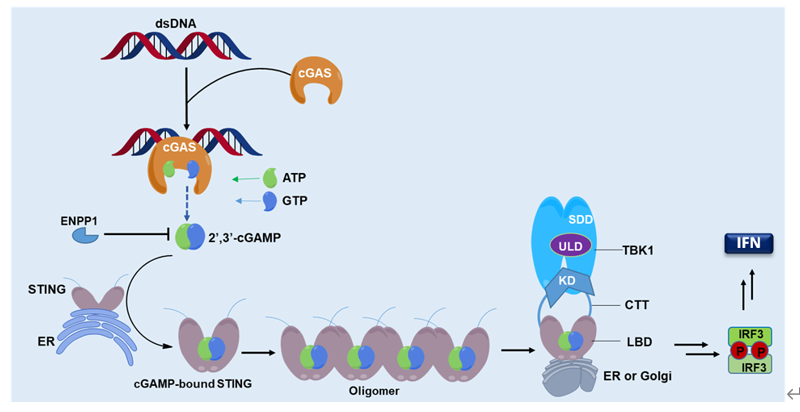
Figure 1. The cGAS?STING?TBK1 signaling pathway (Acta Pharm Sin B 2020).
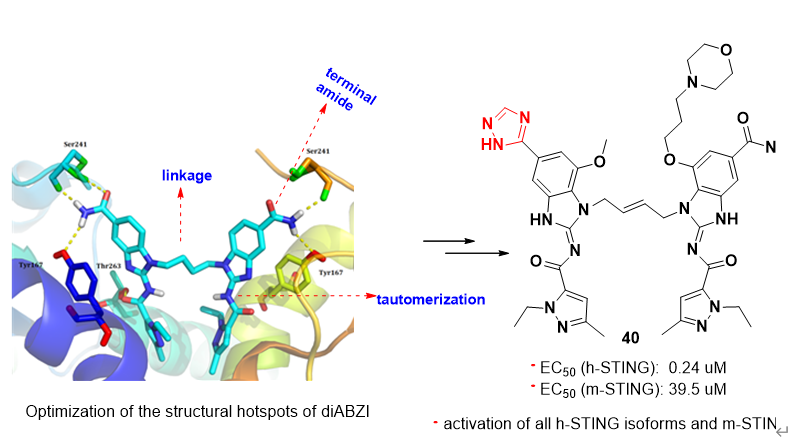
Figure 2. Design of new STING agonists by hotspots elaboration of Amidobenzimidazole framework (J Med Chem 2021).
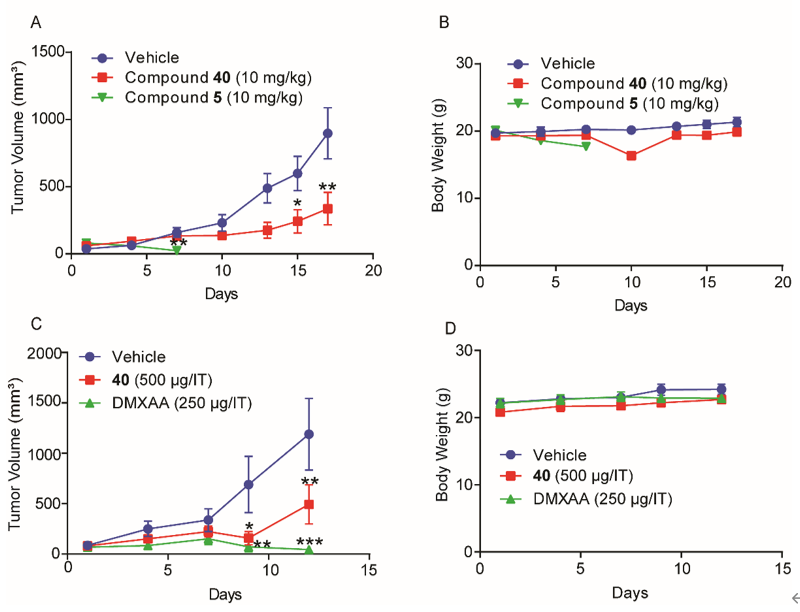
Figure 3. In vivo anti-tumor effects of new agonist 40 (J Med Chem 2021).
文章鏈接:
(1)https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7745059/pdf/main.pdf
(2)https://pubs.acs.org/doi/10.1021/acs.jmedchem.0c01900
參考資料
[1] 科研動態 | 藥學院張翱課題組及合作團隊在STING激動劑研究中獲新進展http://pharm.sjtu.edu.cn/news/3671.html
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn