

該研究成果以“Immunostimulant hydrogel for the inhibition of malignant glioma relapse post-resection”為題發表于國際知名期刊Nature Nanotechnology(中科院JCR期刊1區,五年平均影響因子: 40.301)上。藥學院研究生張晶、陳晨為該論文共同第一作者,姜新義教授為通訊作者,山東大學為唯一通訊單位。
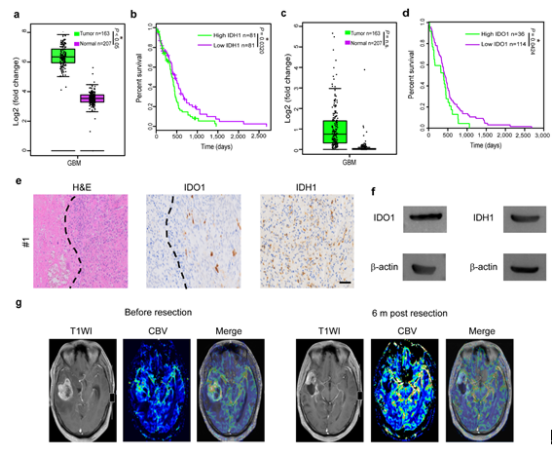
免疫治療為癌癥治療帶來了前所未有的改變和希望,FDA已批準PD-1/PD-L1及CTLA4等多款單抗藥物用于多種惡性腫瘤的臨床干預和治療,并獲得令人滿意的療效。然而,目前尚沒有針對惡性腦腫瘤尤其是多形性神經膠質母細胞瘤(GBM)成功的免疫治療方案。GBM腫瘤微環境高度復雜,多重因素限制了GBM免疫治療策略的開發,其中細胞毒性T細胞匱乏和免疫抑制型細胞(如Treg)聚集是制約GBM免疫治療的主要因素之一。根據WHO對GBM的最新分型標準,GBM分為IDH野生型、IDH突變型和NOS型,其中90%以上GBM IDH突變為IDH1型突變。IDH1和IDO1是兩種典型的與免疫抑制相關的生物標志物,通過深入的生物信息學分析和數據挖掘,研究者發現兩者mRNA在GBM患者腫瘤組織中均呈現高表達,而且兩者均表現出與患者生存期負相關性。通過GBM患者臨床樣本分析,研究者進一步確證了腫瘤組織IDH1和IDO1的表達水平明顯高于癌旁正常腦組織。IDH1突變可下調IFN-γ誘導型趨化因子CXCL10,從而降低對活化T細胞的招募,導致活化T細胞不能高效進入中樞神經系統。IDO1可促進色氨酸向犬尿氨酸的轉變,增加免疫抑制型Treg 細胞在腫瘤組織的聚集。通過沉默IDO1調控腫瘤氨基酸代謝,可緩解Treg細胞相關的免疫抑制作用。
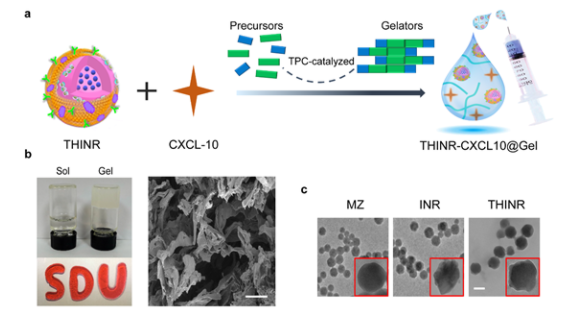
鑒于此,山東大學藥學院姜新義教授團隊在自組裝寡肽水凝膠和仿生納米免疫調節劑基礎上構建了一種可原位重塑腫瘤免疫微環境的納米免疫調節劑-水凝膠超結構遞藥系統,該系統具有優良的生物相容性、可注射性、駐留性和藥物貯庫功能,可無縫銜接現行的臨床手術治療方案,通過多種途徑級聯重塑腫瘤殺傷的免疫微環境遏制術后GBM的復發。
小膠質細胞對腦腫瘤細胞具有天然的趨化作用,其數量超過膠質瘤中其他各類免疫細胞數量的總和,是腦腫瘤組織中最多的細胞之一。本研究中作者通過對腫瘤相關小膠質細胞/巨噬細胞仿生構建了具有腫瘤歸巢作用的納米免疫調節劑用于追蹤定位腦腫瘤微小遷移灶并觸發腫瘤細胞免疫原性死亡,產生腫瘤相關抗原,增加T淋巴細胞的激活;利用水凝膠貯庫對趨化因子CXCL10的緩釋作用,實現了活化T細胞向中樞神經系統的募集;最后,通過沉默IDO1調控腫瘤細胞氨基酸代謝克服Tregs相關的免疫抑制,進一步放大了該腫瘤殺傷的免疫反應。
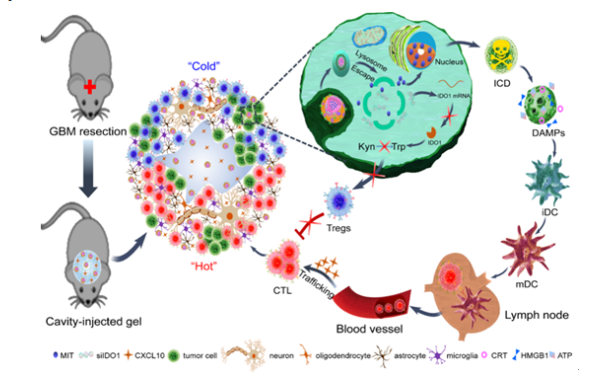
姜新義教授團隊從臨床實踐出發,以腦腫瘤臨床治療問題為導向,利用Big Data深入挖掘腦腫瘤基因庫數據潛在線索提出立論假說,從分子水平、細胞水平和動物組織水平論證了該仿生納米免疫調節劑-水凝膠超結構遞藥系統誘導免疫原性死亡,激活和招募T淋巴細胞,沉默IDO1解除Treg細胞免疫“剎車”的功能和效率,闡明了該系統重塑“熱”腫瘤免疫微環境遏制GBM術后復發潛在的免疫學和分子生物學調控機制,為IDH1突變型GBM患者術后免疫治療提供了有力的理論依據和實驗參考,對其他“冷”腫瘤的術后免疫治療也具有一定的借鑒意義和啟示作用。目前研究團隊就該研究成果已申請中國和PCT專利,正深入探索和開發該水凝膠系統的臨床應用,以期為惡性腫瘤的術后治療提供新策略。
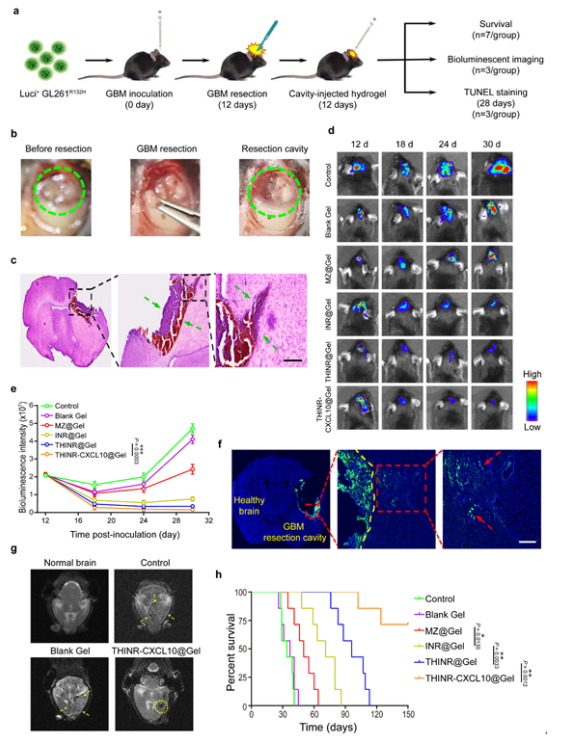
近年來,姜新義教授團隊在惡性腫瘤免疫治療與基因干預等方面取得了一系列重要成果,先后發表于Nature Nanotechnology, PNAS, ACS Nano, Biomaterials, Journal of Controlled Release等期刊上。該項工作得到了國家自然科學基金、國家重大新藥創制項目、山東省重大科技創新項目、山東大學青年交叉學科創新群體基金等項目的資助。
原文鏈接:https://doi.org/10.1038/s41565-020-00843-7
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn