

從Harrisonia perforata中分離出的痕量化合物(+)-Haperforin G(6)(37 mg/25 kg)是新發現的一種重要的檸檬苦素類(limonoid)四降三萜類天然產物(圖1)。由于Haperforin G是人11β羥類固醇脫氫酶1型(11β-HSD1)(IC50 0.58 μM)的有效抑制劑,因此受到了生物醫學界的關注。
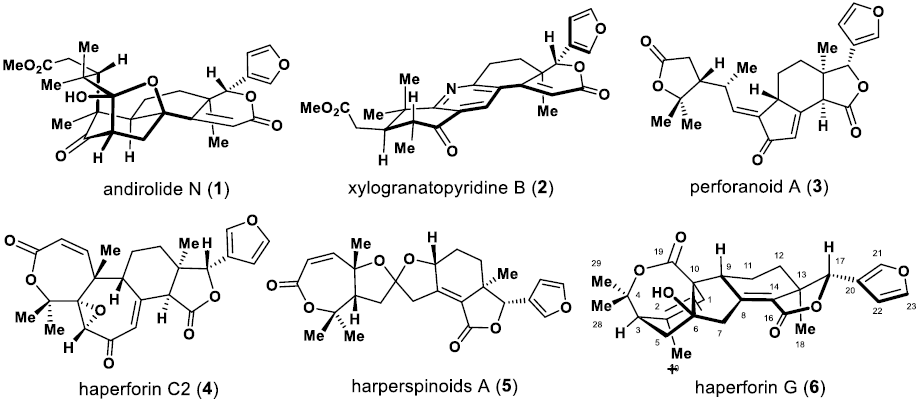
圖1. Haperforin G及相關limonoids(圖片來源:J. Am. Chem. Soc.)
鑒于haperforin G的生物學重要性及其天然來源的稀缺性,針對其不對稱全合成和衍生化的簡潔方法的開發將提供足夠的原料,以探索6的生物學功能。6的結構包含一個新穎的檸檬苦素6/5/6三環碳骨架,該骨架含有六個手性中心(包括兩個全碳季碳手性中心),兩個內酯環和一個3-取代的呋喃環。合成6的最具挑戰性的方面是實現其兩個全碳季碳(C10和C13)和一個手性叔醇(C6)的對映選擇性構建以及三取代(C1和C2)和四取代(C8和C14)雙鍵的區域選擇性安裝。
作者對6的逆合成分析如圖2所示。為了多樣性合成其其他家族成員,作者設計了一種匯聚策略,其中兩個片段(烯酮7和碘化物8)將通過可見光氧化還原催化的烷基自由基偶聯反應連接C11-C12鍵,隨后進行分子內羥醛縮合和脫水,以組裝多環母核。這將利用兩個片段7和8中的手性中心來影響新創建片段的立體化學結果。但在haperforin G的全合成中實施這種匯聚策略需要開發有效的對映體7和碘化物8的對映選擇性合成方法。
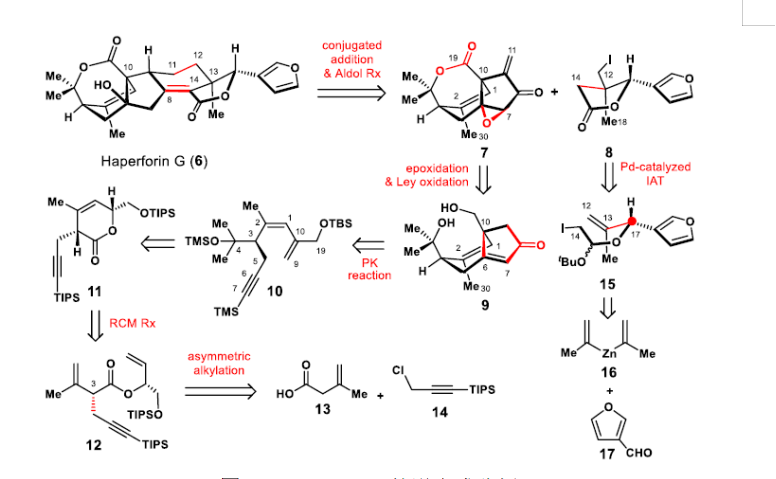
圖2. Haperforin G的逆合成分析(圖片來源:J. Am. Chem. Soc.)
作者預想7的七元內酯環可以通過Ley氧化二醇9并借助其有利的船形構象而生成,并且7的環氧可以通過Weitz-Scheffer環氧化選擇性地安裝。二醇9可由烯炔10通過分子內PK反應制備。反過來,烯炔10可以很容易地通過兩次鈰(III)介導的格氏反應從內酯11得到。內酯11中順式雙鍵(C1和C2)的區域選擇性合成可以通過Roulland和Ermolenko開發的關環復分解反應(RCM)由二烯12實現。二烯12中的C3手性中心是由商業可得的烯基羧酸13和氯化物14與手性鋰酰胺作為無跡輔劑通過Zakarian的高度對映選擇性烷基化而產生的。
而且,預期從烷基碘化物15通過鈀催化的碘化物原子轉移環化(IATC)非對映選擇性地產生帶有C13全碳季碳手性中心的碘內酯8。而15可由3-exomorpholine-isoborneol(MIB)介導的烯基鋅試劑16與醛17的對映選擇性親核加成反應得到。
本文的研究始于對3-甲基-3-丁烯酸(13)的立體選擇性烷基化的探索,以安裝C3烷基(圖3)。Zakarian的對映選擇性烷基化方案為實現所需的立體選擇性提供一種簡潔的方法。-78 °C下在手性四胺A(1.05當量)存在下用正丁基鋰(4.0當量)處理13,然后加入氯化物(14,1.2當量),生成的酸18帶有R-構型的C3手性中心,產率77%,ee為91%,γ-烷基化異構體的含量為13%。醇19在DCC/DMAP條件下與酸18反應,得到二烯12的收率為78%,然后進行Grubbs-II催化的RCM反應,以76%的收率得到內酯11,為單一的非對映異構體。因此,通過簡潔的三步操作,作者完成了具有所需手性中心(C3和C10)和順式三取代烯烴(C1 = C2)的11的對映和區域選擇性制備。內酯11在CeCl3的存在下進一步與過量的甲基溴化鎂反應,然后用TBAF脫保護,以88%的收率得到三醇20。由于手性四胺A易于回收,因此該化學方法適用于三醇20的大規模合成。
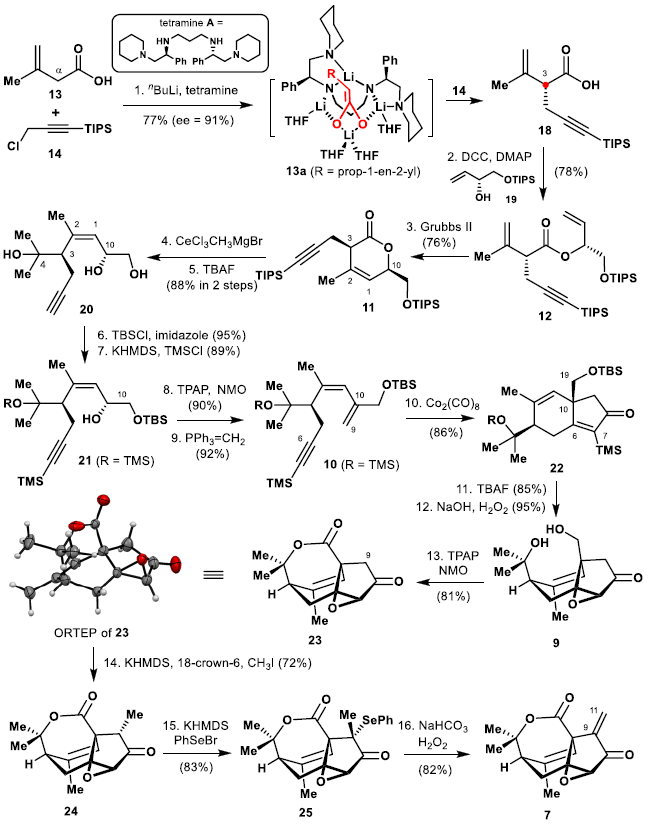
圖3. 烯酮7的合成(圖片來源:J. Am. Chem. Soc.)
然后,作者嘗試通過PK反應非對映選擇性地合成帶有橋頭全碳季碳中心的22。 為此,首先通過硅保護和去硅保護將20轉化為21,產率85%。用過釕酸四丙基銨和N-甲基嗎啉N-氧化物(TPAP/NMO)在21中進一步氧化仲醇可生成相應的酮,然后進行Wittig反應,以83%的收率得到10,為關鍵的PK環化反應做好準備。
通過條件篩選,在110 ℃的CO球囊壓力下將烯炔10暴露于催化量的Co2(CO)8(20 mol%)36小時后,形成了預期的二烯酮22,收率為86%。用TBAF進一步處理22后,通過在NaOH的存在下用H2O2處理所得的二醇,通過Weitz-Scheffer環氧化以區域和非對映選擇性的方式產生了環氧化物9(總收率81%)。對二醇9進行Ley氧化,可將其直接轉化為相應的內酯23,收率81%。23的結構及立體化學由單晶予以確證。
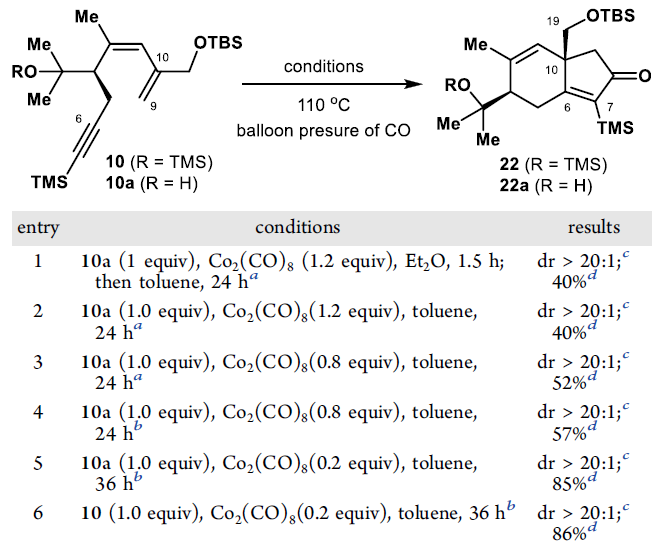
圖4. Co-介導的PK反應條件優化(圖片來源:J. Am. Chem. Soc.)
為了將C9/C11雙鍵引入到烯酮7中,在18-crown-6存在下,用KHMDS處理,將23進行甲基化,然后與碘甲烷反應以72%的產率產生24。用KHMDS和PhSeBr進一步處理24,將其轉化為25,收率為83%。在NaHCO3存在下用H2O2氧化25得到烯酮7,產率為82%。通過單晶X-射線衍射分析證實了24和25的結構。
完成了對烯酮7的合成,作者將注意力轉向了具有檸檬苦素基元和C13全碳季碳中心的碘代內酯8的合成。15的Pd-催化碘化物轉移環化(IATC)反應是8合成的最直接方法。為此,17與烯基鋅16在Nugent(+)-MIB介導的對映選擇性烯基化條件下反應,得到具有理想C17手性中心的烯丙醇26,收率為93%,且ee極好。NIS介導的叔丁基乙烯基醚對26的分子間縮酮化反應得到碘化物15,產率93%(圖5)。
經過優化以后,碘化物15進行了Pd-催化的IATC反應,以60%的收率(81%brsm)得到碘化物27,從而在C13處形成了關鍵的全碳季碳中心。最后,Jones氧化27,形成碘內酯8,產率為65%。
在得到兩個關鍵片段烯酮7和碘化物8之后,作者繼續進行(+)-haperforin G(6)的全合成。最初,作者嘗試使用AIBN/Bu3SnH介導的烯酮7和碘化物8偶聯的傳統方法。但是,這導致偶聯產物的收率較低。受近期光氧化還原催化的C-C鍵形成的啟發,作者篩選了各種光氧化還原催化條件。發現在藍光下,在催化量的[Ir(ppy)2(dtbbpy)]PF6*(2.5 mol%)存在下,并使用Hantzsch酯作為還原劑,未活化的C(sp3)基的碘化物8可以轉化為其相應的烷基自由基,并與烯酮7分子間偶聯,以64%的收率生成28,為單一的非對映異構體。
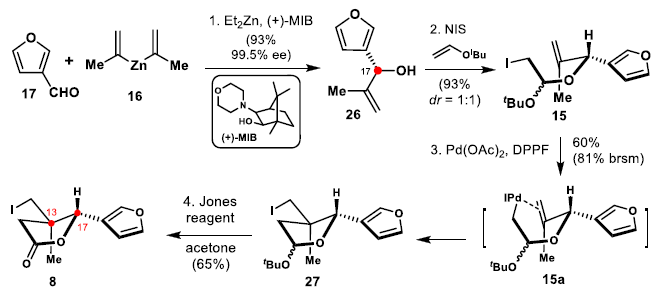
圖5. 碘代物8的合成(圖片來源:J. Am. Chem. Soc.)
在非對映選擇性構建了28中關鍵的C9-C11鍵之后,作者將精力集中在擬議的分子內羥醛縮合反應以形成中心C環,隨后將區域選擇性引入(+)-haperforin G(6)的四取代雙鍵。
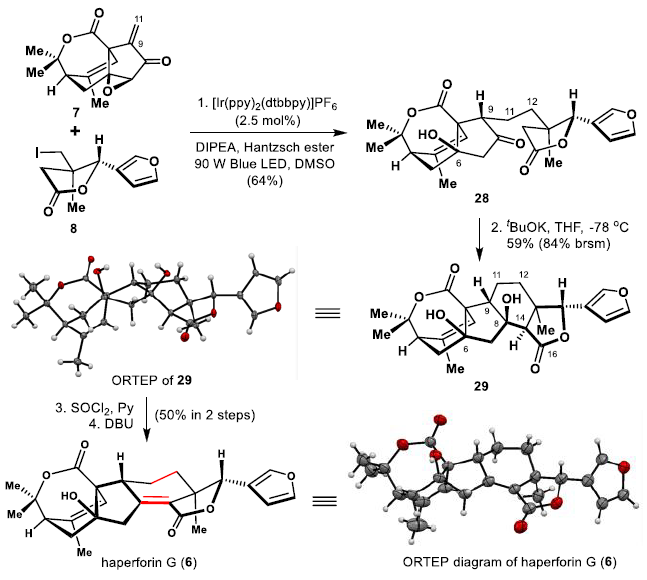
圖6. (+)-haperforin G的全合成(圖片來源:J. Am. Chem. Soc.)
為此,在-78 ℃下在四氫呋喃中用t-BuOK處理28,經分子內Aldol反應,以單一的立體異構體形式產生29,收率59%(brsm 84%)。隨后通過單晶證實了29的結構(圖6)。最后,利用C-6上羥基的存在,用SOCl2/py處理29,然后將其用DBU消除得到(+)-haperforin G(6),總產率為50%。通過單晶X-射線分析明確證實了6的結構;合成6的光譜和旋光數據與天然產物報道的一致。
總結:北京大學楊震教授團隊首次從市售起始原料出發,以20步成功合成了結構復雜的(+)-haperforin G(6),總收率為2.0%,該全合成還確定了(+)-haperforin G(6)的絕對構型。該合成的高效及關鍵特征在于:1)Co-催化分子內PK反應對帶有C10全碳季碳中心的D環的非對映選擇性構建;2)光氧化還原催化反應實現兩個片段烯酮7和碘化物8的匯聚和非對映選擇性連接,最大程度地減少了氧化還原操作和保護基的使用;3)手性四胺介導的C3手性中心的對映選擇性構建;4)MIB介導的C17手性中心的對映選擇性安裝;5)Pd-催化的分子內碘轉移反應,用于生成C13全碳季碳中心。本文開發的化學方法為haperforin G及其類似物的大規模合成及生物活性篩選打下了堅實的基礎。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn