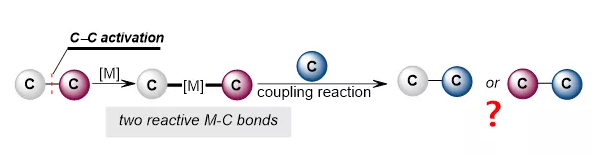
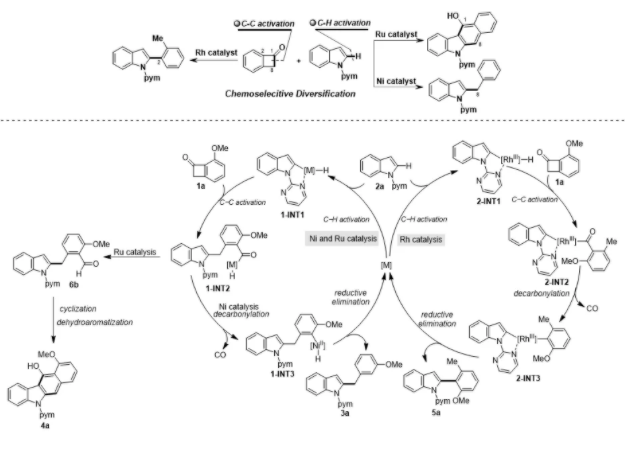
酮類結構是許多天然分子和生物活性分子中不可缺少的結構單元,也是化學合成研究中重要的反應基團,因此,酮類化合物的高效轉化一直是化學家關注的重點。過渡金屬催化的碳—碳活化策略近些年在酮類化合物的轉化中已經取得了不錯進展,但依舊存在一些亟待解決的關鍵問題:1. 過渡金屬對羰基碳??碳鍵氧化加成會產生兩種不同活性的碳—金屬鍵,實現這兩種鍵的選擇性反應仍然面臨巨大挑戰;2. 酰基金屬中間體存在可逆的羰基脫除與插入過程,而這也對兩種碳—金屬鍵活性的調整帶來了困難。西北大學魏顥課題組長期致力于過渡金屬催化羰基轉化反應研究,在羰基的脫除、遷移轉化中取得了原創性研究成果。近期,在原有工作基礎上,該課題組提出了催化劑控制的羰基轉化策略,以期實現對兩種活性碳??金屬鍵反應的選擇性控制。該課題組首先選用苯并環丁酮為底物,利用碳—氫活化與碳—碳活化相結合的策略,通過不同金屬催化劑的選擇,成功實現了苯并環丁酮向吲哚和咔唑衍生物的多樣性轉化:(1)當采用Ni(cod)2為催化劑時,苯并環丁酮8位碳原子與吲哚偶聯,同時進一步發生脫羰,最終得到吲哚2位芐基化的產物;(2)當采用Ru3(CO)12為催化劑時,苯并環丁酮8位碳原子與吲哚偶聯后未發生脫羰,羰基可以進一步參與環化構筑咔唑骨架;(3)而當采用Rh(PPh3)3Cl為催化劑時,該課題組觀察到了完全不同的選擇性,苯并環丁酮1位碳原子與吲哚發生偶聯并進一步脫羰,最終實現了苯并環丁酮2位與吲哚的偶聯,得到了芳基化吲哚。該工作通過催化劑的合理選擇,不僅實現了不同碳—金屬鍵的選擇性偶聯,同時也為不同活性的碳—金屬鍵反應性的調整提供了新思路(Angew. Chem. Int. Ed. 2020, 10.1002/anie.202010244)。
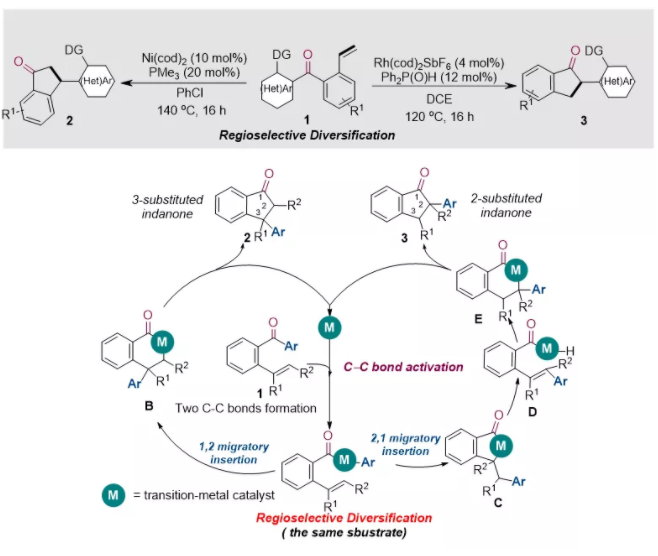
基于過渡金屬催化劑在碳—金屬鍵選擇性偶聯中出色的調控能力,該課題組進一步探索了催化劑控制的羰基轉化策略在烯烴碳酰化反應中的應用。他們采用含有末端烯烴的吲哚酮衍生物為底物,通過合理的金屬催化劑選擇,成功實現了催化劑控制的烯烴區域選擇性碳酰化。該課題組發現,當采用Ni(cod)2為催化劑時,酰基—金屬中間體會與烯烴發生1,2-遷移插入,得到3位芳基取代的茚滿酮;而當催化劑調整為Rh(cod)2SbF6時,酰基—金屬中間體與烯烴插入的區域選擇性發生了改變,通過2,1-遷移插入最終得到了2位芳基取代的茚滿酮。該工作通過催化劑控制的區域選擇性反應成功實現了吲哚酮類化合物向茚滿酮類骨架的多樣性轉化,為取代茚滿酮的制備提供了一種高原子經濟性的新方法(CCS Chem. 2020, 10.31635/ccschem.020.202000448)。
總結:西北大學魏顥課題組成功報道了催化劑控制的酮類化合物多樣性轉化新方法,通過研究催化劑對碳—金屬鍵反應選擇性的影響,不僅有助于理解不同過渡金屬催化劑在碳—碳鍵斷裂中的特點,而且也為碳—碳鍵活化體系的探索開辟了新路徑。




