



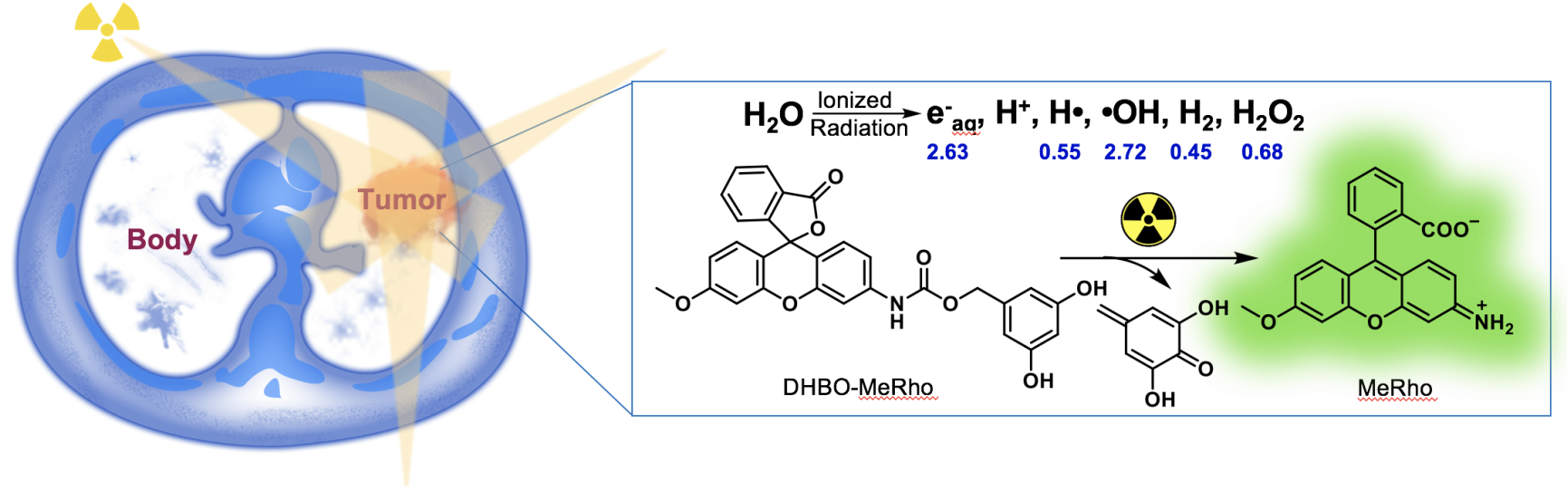
近來,主動(dòng)激活的活體剪切化學(xué)發(fā)展迅速,但也遇到諸多困難。主流的活體剪切反應(yīng)主要基于小分子激活劑、紫外光及可見光等。相比于小分子激活,光激活策略具備高時(shí)間空間分辨率的優(yōu)勢,但也存在穿透深度不足的問題,難以運(yùn)用于組織深層。而X射線等外源輻射則沒有組織穿透力的局限,同時(shí)隨著三維放療等現(xiàn)代放療技術(shù)的發(fā)展,其空間分辨率可達(dá)亞毫米甚至微米級別。北京大學(xué)劉志博課題組致力于發(fā)展新型活體可控釋放化學(xué),并取得若干原創(chuàng)性成果。
在該文中,劉志博課題組率先報(bào)道了核輻射驅(qū)動(dòng)的活體剪切化學(xué),基于放射性穿透力強(qiáng)、時(shí)空分辨率高的優(yōu)勢,核輻射激活有望精確調(diào)控體內(nèi)化學(xué)鍵的斷裂,彌補(bǔ)光激活手段的不足,實(shí)現(xiàn)核輻射驅(qū)動(dòng)的活體干預(yù)(Radiation-Activated Perturbing, RAP)。與其他激活手段相比,該策略具有:1)高時(shí)空分辨率;2)高組織穿透能力;3)高臨床相關(guān)性。作為一類輻射引發(fā)的可控釋放策略,RAP策略有著明確的臨床應(yīng)用價(jià)值。目前,有近一半的癌癥患者需接受放療。單純接受放療癌癥易復(fù)發(fā),預(yù)后差,通常需要與化療相結(jié)合。但傳統(tǒng)化療藥物效果往往不理想,毒副作用強(qiáng)。基于RAP策略借助外源輻射激活體內(nèi)化療前藥,有望實(shí)現(xiàn)腫瘤特異的可控藥物釋放,發(fā)展放療引導(dǎo)的腫瘤精準(zhǔn)化療。
北京大學(xué)化學(xué)與分子工程學(xué)院的博士研究生傅群峰為該文的第一作者,劉志博老師為通訊作者。該工作得到了國家自然科學(xué)基金委、李革-趙寧生命科學(xué)青年研究基金、科技部、北京大學(xué)基礎(chǔ)加強(qiáng)項(xiàng)目、化學(xué)與分子工程學(xué)院以及北大-清華生命科學(xué)聯(lián)合中心的資助。同時(shí),作者感謝馬會民教授、翟茂林教授、饒毅教授、李月敏教授對該課題給予的建議和幫助。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn