- 首頁
- 資訊
香港科技大學孫建偉課題組Angew: 通過不對稱1,8-共軛加成反應構建四取代手性聯烯類化合物
來源:化學加編輯部 暖冬 2020-07-17
導讀:香港科技大學孫建偉課題組報道了手性磷酸催化吲哚取代的炔丙醇與3-苯基吲哚或1-萘酚的不對稱1,8-共軛加成反應,能以良好至優秀的收率及對映選擇性得到一系列四取代聯烯化合物。同時,對照實驗的結果表明遠程控制的1,8-共軛加成反應中涉及的原位生成的吲哚亞甲基亞胺(indole imine methide)類化合物是通過雙功能過渡態轉化而來的。該成果發表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.202006137)。
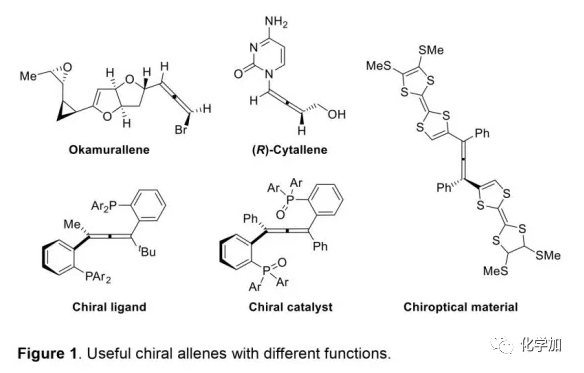
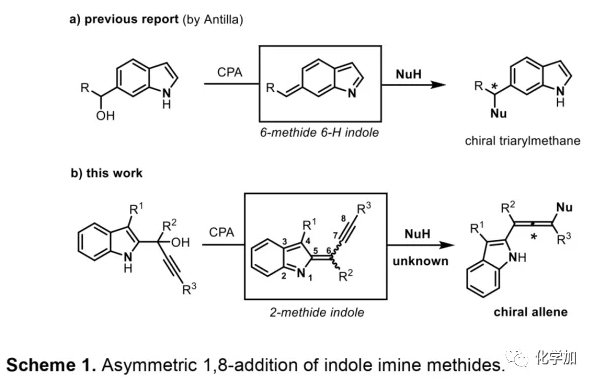
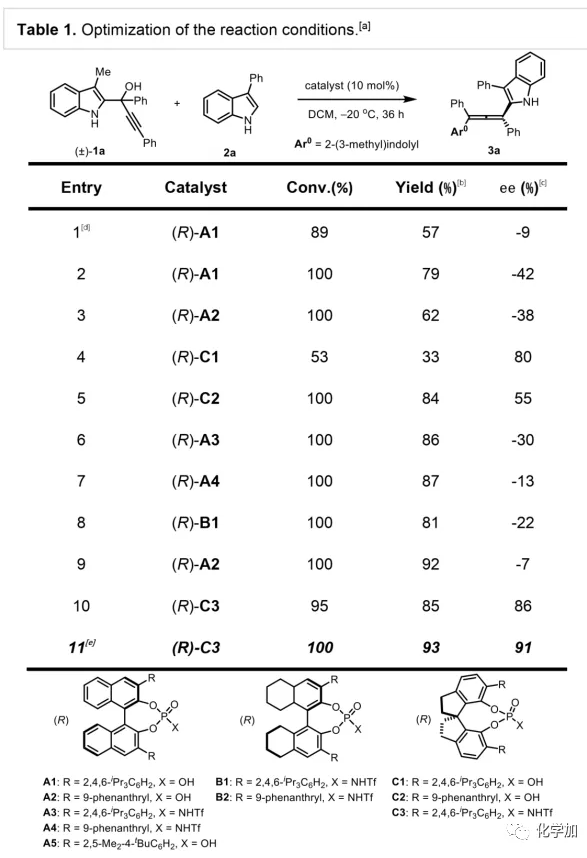
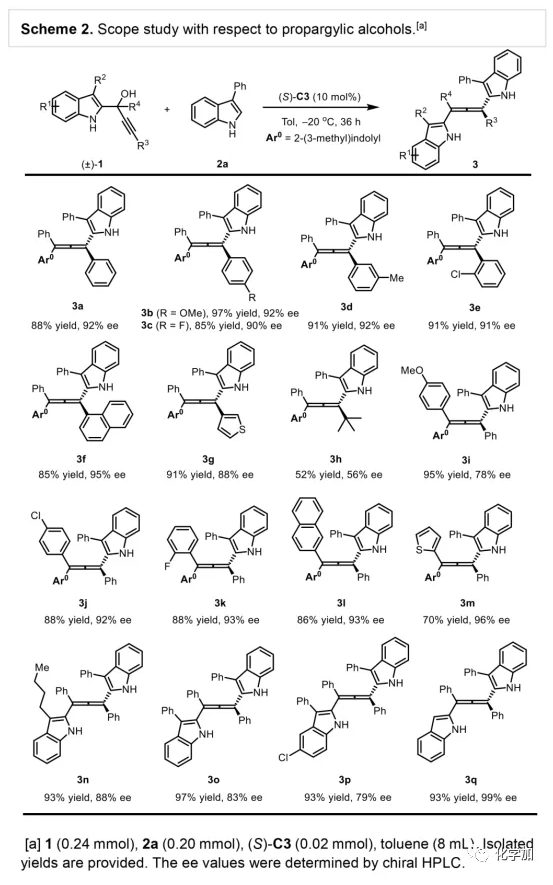
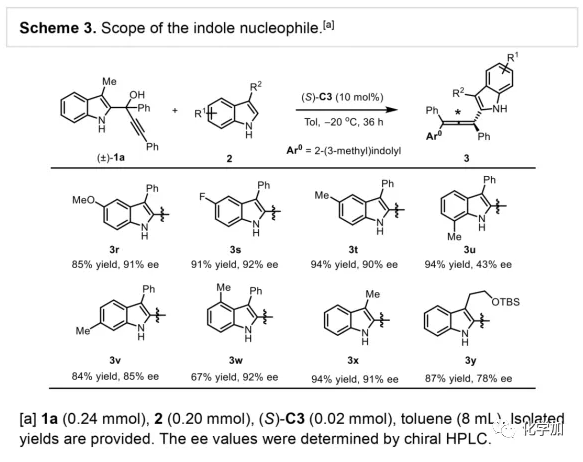
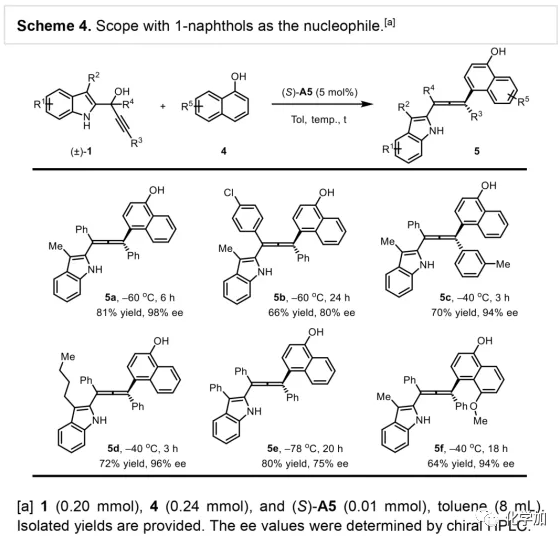
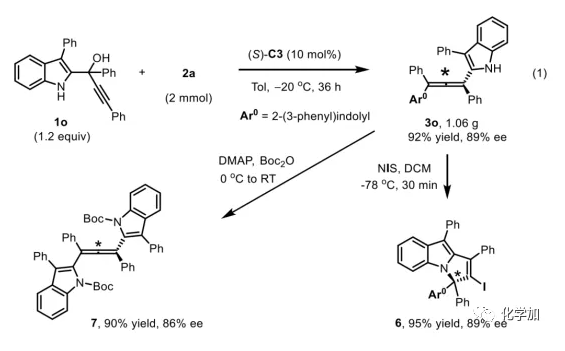
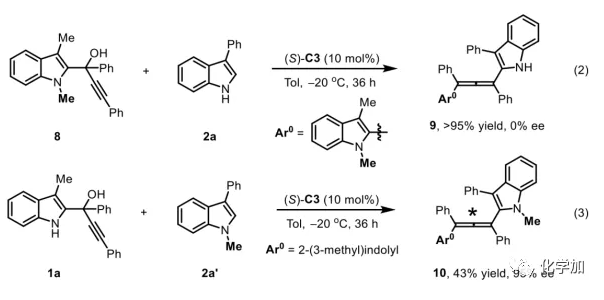
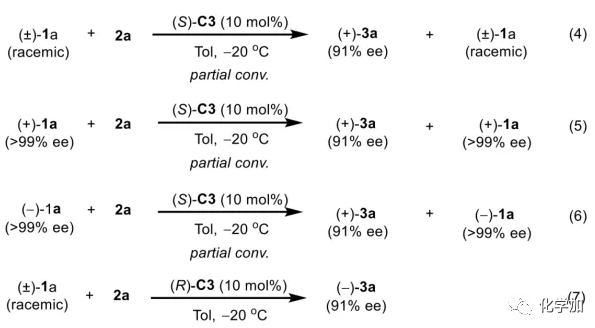
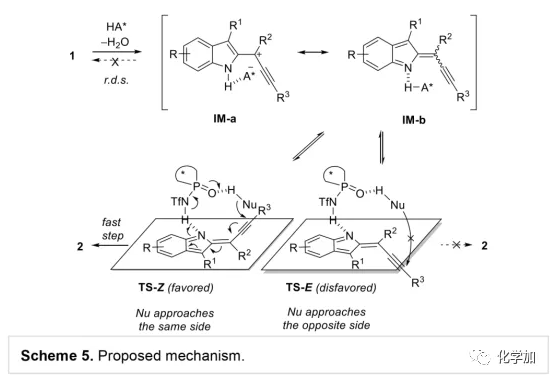
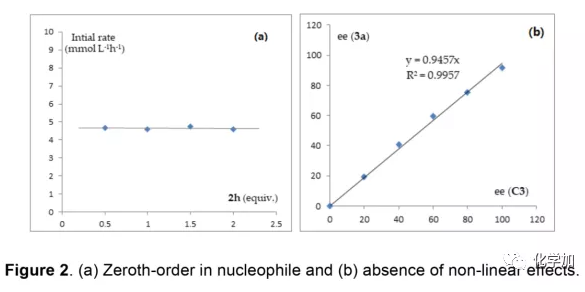
軸手性聯烯類化合物廣泛存在于天然產物、藥物、配體、有機催化劑以及多功能材料中(Figure 1),因此,軸手性聯烯類化合物的不對稱合成成為化學家們關注的重點。傳統的合成軸手性聯烯類化合物的方法主要包括消旋聯烯類化合物的拆分和手性炔丙醇前體的轉化這兩種。隨著時代的發展,不對稱合成軸手性聯烯類化合物已經取得了不錯的進展,但有機催化合成軸手性聯烯類化合物仍然面臨巨大挑戰。 (圖片來源:Angew. Chem. Int. Ed.)手性吲哚衍生物是多種具有生物活性的天然產物和藥物的核心結構。而吲哚醇原位生成相應的亞胺類化合物與親核試劑反應是合成手性吲哚衍生物最直接有效的方法,但這種吲哚亞甲基亞胺類化合物主要局限于環加成反應、1,4-或1,6-共軛加成反應,而遠程控制吲哚亞甲基亞胺類化合物的1,8-共軛加成仍然面臨巨大挑戰。最近,Antilla課題組成功實現了手性磷酸催化富電子芳烴與6-甲基-6H-吲哚不對稱1,8-加成反應(Scheme 1a)。受到該報道的啟發,香港科技大學孫建偉課題組報道了手性磷酸催化吲哚衍生的炔丙醇與3-苯基吲哚或1-萘酚的遠程不對稱1,8-共軛加成反應,能以良好至優秀的收率及對映選擇性得到一系列四取代聯烯化合物(Scheme 1b)。(圖片來源:Angew. Chem. Int. Ed.)作者以消旋的炔丙醇1a和3-苯基吲哚2a為模板底物,通過對催化劑、溶劑以及溫度等反應條件進行篩選,確定最優的反應條件(Table 1):10 mol% (S)-C3為催化劑,甲苯為溶劑,在-20 ℃條件下反應36 h,能以88%的收率和92%的對映選擇性得到產物3a。(圖片來源:Angew. Chem. Int. Ed.)在最優反應條件下,作者對炔丙醇的底物范圍進行了考察(Scheme 2)。各種芳基取代、雜環取代以及位阻較大的萘環、叔丁基取代的炔丙醇都能較好的適應反應條件,能以良好至優秀的收率和對映選擇性得到相應產物。但4-甲氧基苯基取代的炔丙醇則只能以較低的對映選擇性得到相應產物,可能是因為4-甲氧基苯基基團與2-吲哚基團在陽離子中間體的形成中存在競爭關系。(圖片來源:Angew. Chem. Int. Ed.)接著,作者考察了3-苯基吲哚的底物范圍(Scheme 3)。各種C4-位、C5-位和C6-位取代的3-苯基吲哚以及3-烷基吲哚均能較好的適應反應條件,能以良好至優秀的收率及對映選擇性得到相應產物。但C7-位甲基取代的3-苯基吲哚則只能以較低的對映選擇性得到相應產物,可能是因為C7-位的甲基會影響N-H鍵與手性磷酸氫鍵的形成。(圖片來源:Angew. Chem. Int. Ed.)1-萘酚也可作為親核試劑參與該類不對稱共軛加成反應(Scheme 4)。通過簡單優化反應條件,作者確定1-萘酚與炔丙醇發生不對稱1,8-共軛加成反應的最優反應條件。同時,在最優反應條件下,各種炔丙醇與1-萘酚4都能較好的適應反應條件,能以良好至優秀的收率及對映選擇性得到相應聯烯產物。(圖片來源:Angew. Chem. Int. Ed.)為了證明該反應的應用潛力,作者進行了放大規模反應和衍生反應(Eq. 1)。將2a的用量擴大至2 mmol,產物的收率及對映選擇性均沒有明顯的降低。3o在NIS的二氯甲烷溶液中可發生軸手性到碳中心手性的轉化,得到雜環化合物6。同時,3o中的N-H可被Boc基團保護,從而可以進行更多的衍生反應而不受N-H基團的影響。其中,3o和6的絕對構型通過單晶確定。(圖片來源:Angew. Chem. Int. Ed.)為了進一步了解反應機理,作者進行了一系列對照實驗。N-甲基取代的炔丙醇8能順利發生1,8-共軛加成反應,但得到的產物的對映選擇性為0,這說明N-H鍵對反應對映選擇性的控制起著至關重要的作用(Eq. 2)。N-甲基吲哚2a′能與炔丙醇發生反應,能以中等的收率和優秀的對映選擇性得到相應產物,這說明親核試劑的N-H鍵可以加速反應的進行(Eq. 3)。(圖片來源:Angew. Chem. Int. Ed.)為了證明反應是否經歷SN2'過程和動力學拆分過程,作者又進行了一系列對照實驗。標準反應條件下,作者監測反應產物和炔丙醇的ee值,發現產物的ee值保持在91%且消旋的炔丙醇也一直保持在消旋狀態(Eq. 4)。此外,作者利用(+)-1a或(-)-1a分別參與反應,分別得到相同構型的產物(+)-3a或(-)-3a,回收底物的ee值也保持不變(Eq. 5-6)。此外,作者將催化劑的構型變為R-構型,產物的構型也隨之變為相反構型,這說明產物的構型是由催化劑決定的(Eq. 7)。這些結果表明該反應不經歷SN2'過程和動力學拆分過程。(圖片來源:Angew. Chem. Int. Ed.)根據實驗結果,作者推測可能的反應機理(Scheme 5)。首先,在手性磷酸作用下,炔丙醇發生脫水過程轉化為離子對IM-a,IM-a可異構化為手性磷酸活化的亞胺亞甲基中間體IM-b。接著,親核試劑進攻炔丙醇的炔基會形成兩種過渡態TS-E和TS-Z。在過渡態TS-Z中,親核試劑進攻炔基的方向與氫鍵方向保持一致,而在過渡態TS-E中則正好相反,而經歷TS-E過渡態生成的E-構型產物又會轉化為中間體IM-a。因此,該反應最后是經歷TS-Z過渡態轉化為Z-構型產物。(圖片來源:Angew. Chem. Int. Ed.)最后,作者對反應進行了動力學研究。隨著親核試劑用量的增加,反應速率不發生變化(Figure 2a)。這表明親核試劑進攻這一步不是決速步驟。同時,產物的ee值和催化劑的ee值呈線性關系(Figure 2b)。這表明只有一個催化劑分子參與該反應,從而排除了多個催化劑同時參與反應的可能。 (圖片來源:Angew. Chem. Int. Ed.)
總結:香港科技大學孫建偉課題組報道了手性磷酸催化吲哚取代的炔丙醇與3-苯基吲哚或1-萘酚的不對稱1,8-共軛加成反應,能以良好至優秀的收率及對映選擇性得到一系列四取代聯烯化合物。同時,對照實驗的結果表明遠程控制的1,8-共軛加成反應中涉及的原位生成的吲哚亞甲基亞胺類化合物是通過雙功能過渡態轉化而來的。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn