

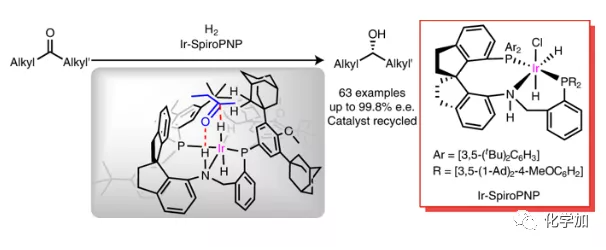
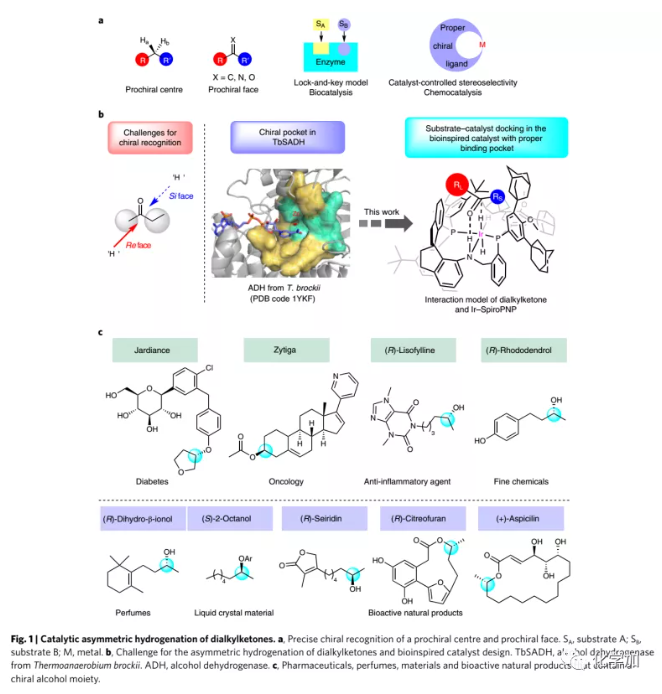
合成化學的主要任務之一是開發立體選擇性反應合成光學活性分子如手性藥物、農藥和精細化學品。不對稱催化是控制立體選擇性的有效方法,但手性催化劑難以區別兩個含相似位阻和電性的基團的前手性中心/面。因此,控制二烷基酮這種底物的立體選擇性反應充滿挑戰,并且通過化學催化使這些底物進行不對稱反應特別困難。然而,在生物催化反應中,次級相互作用如氫鍵、靜電/偶極相互作用以及蛋白芳香殘基的π-π堆積可以確保酶和底物之間的準確識別,從而誘導優異的立體選擇性。受生物催化模型的啟發,有機化學家們開發了各種策略來控制立體選擇性,包括基于催化劑的控制,其依賴于為特定的不對稱反應進行手性催化劑的合理設計(Fig. 1a)。
含兩個空間位阻和電性均相似的烷基酮的催化不對稱氫化異常困難。對于醇脫氫酶催化的酮的不對稱還原,化學家提出了幾種催化模型包括菱形晶格模型和立方體截面模型以了解底物與酶活性位點之間的相互作用。1986年,Keinan等人通過X-射線衍射證實醇脫氫酶在結構上含有一個小口袋和一個大口袋,該酶活性位點的大小和形狀賦予其優異的底物特異性和立體選擇性。受其啟發,含有擁擠且狹窄手性口袋的催化劑對于準確區分進行不對稱氫化的二烷基酮中兩個相似的烷基至關重要(Fig. 1b)。
近日,南開大學周其林院士課題組設計并合成了具有擁擠且狹窄手性口袋的三齒手性螺環膦-胺-膦配體(SpiroPNP)/銥催化劑。螺環膦-胺-吡啶配體(SpiroPNN)在官能團化的芳基酮的不對稱氫化中的優異表現使作者對利用該配體骨架充滿信心。Ir-SpiroPNP催化的各種二烷基酮的不對稱氫化可以優異的對映選擇性產生手性醇,用于藥物、香料、精細化學品、天然產物和液晶的合成(Fig. 1c),該成果發表于近期Nature Catalysis(DOI:10.1038/s41929-020-0474-5)。
(圖片來源:Nature Catalysis)
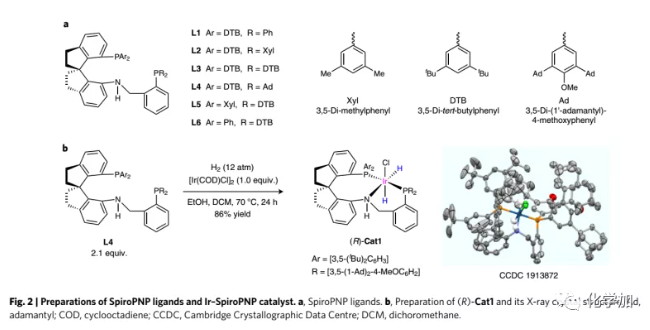
配體和催化劑的制備:作者由相應的螺環氨基膦合成了六個SpiroPNP配體(L1-L6,Fig. 2a),并通過銥催化的2-癸酮(S7)的氫化考察了各自性能,其中L4(Ar=3,5-二叔丁基苯基、R = 3,5-二-(1'-金剛烷基)-4-甲氧基苯基)效果最佳(78% e.e.)。上述結果表明,增大配體的空間體積可以提高對映選擇性。接下來,作者將[Ir(COD)Cl]2與L4在氫氣下絡合制備并分離得到銥催化劑(R)-Cat1(86%,Fig. 2b)。1H和31P NMR以及HR-MS表明(R)-Cat1含有兩個氫與銥原子以順式方式連接,單晶X-射線衍射顯示其活性中心非常擁擠。根據金屬-配體雙功能機理,催化劑中的NH對酮的氫化是必不可少的(Fig. 1b)。催化劑(R)-Cat1非常穩定,在空氣中儲存一個月對其純度或反應性沒有影響,其穩定性源于活性中心被大位阻的配體所掩蓋。
(圖片來源:Nature Catalysis)
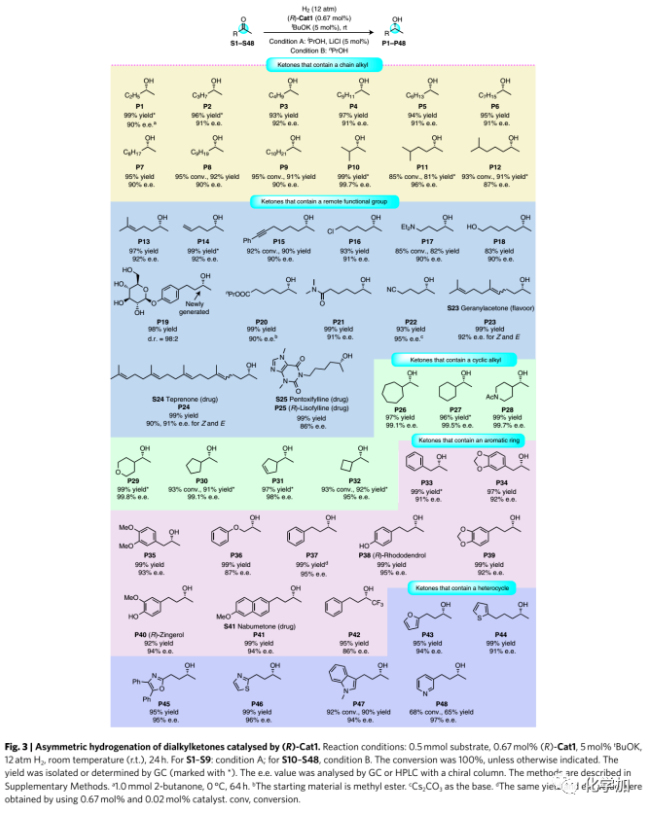
當用(R)-Cat1進行S7的催化氫化時,對映選擇性提高至88% e.e.,通過條件優化(H2壓力、溶劑和添加劑)可以進一步提高對映選擇性(90% e.e.)。在最佳反應條件下,各種二烷基酮均可以氫化(Fig. 3)。在烷基甲基酮的氫化中,(R)-Cat1顯示出很高的對映選擇性,而烷基甲基酮是最具挑戰性的酮底物之一。室溫下,含甲基和長鏈烷基的酮(S1-S12)氫化可以85~100%的轉化率得到相應的醇(87~99.7% e.e.),烷基鏈的長度對立體化學結果影響不大。此外,最具挑戰性的底物2-丁酮(S1)可以分別在室溫(88% e.e.)和0℃(90% e.e.)下經氫化還原得到的2-丁醇(P1),表明(R)-Cat1對底物的甲基和乙基具有區別。在相同反應條件下,(R)-Cat1不能還原芳香酮如苯乙酮。
(圖片來源:Nature Catalysis)
二烷基酮底物的范圍:作者研究了帶有遠程官能團的酮。含烯烴、炔烴、鹵原子、胺和羥基、糖、酯、酰胺以及氰基的底物(S13-S22)均可以實現高轉化率(85~100%)和高對映選擇性(90~95% e.e.)。該方法突出的官能團耐受性顯示出其在藥物合成中的潛在用途,作者還將該方法用于天然香料化合物香葉基丙酮(S23)、胃潰瘍藥物替普瑞酮(S24)和藥物己酮可可堿(S25)的氫化均表現出優異的對映選擇性和收率。此外,環烷基甲基酮(S26-S32)的氫化也以極高的對映選擇性(95~99.8% e.e.)產生仲醇,后者是合成諸如組蛋白甲基化酶EZH2抑制劑等藥物的重要組成部分。同樣,1-芳基-2-丙酮(S33-S36)和4-芳基-2-丁酮(S37-S42)通過不對稱氫化分別得到手性1-芳基-2-丙醇和4-芳基-2-丁醇。其中,醇P34是合成抗癲癇藥物Talampanel的關鍵中間體、醇P36是合成藥物Dibenzyline的原料。此外,也可以通過該方法制備生物活性分子(R)-rhododendrol(P38)、(R)-zingerol(P40)和P41(Nabumetone類似物)。含雜芳環(呋喃、硫代呋喃、噁唑、噻唑、吲哚和吡啶)的酮通過高對映選擇性氫化得到相應的手性醇(P43-P48),是合成各種天然產物和藥物的起始原料。在不影響對映選擇性的情況下,在S37的氫化反應中催化劑(R)-Cat1的負載量可降至0.02 mol%,并且可以循環使用六次而不會損失活性或對映選擇性。
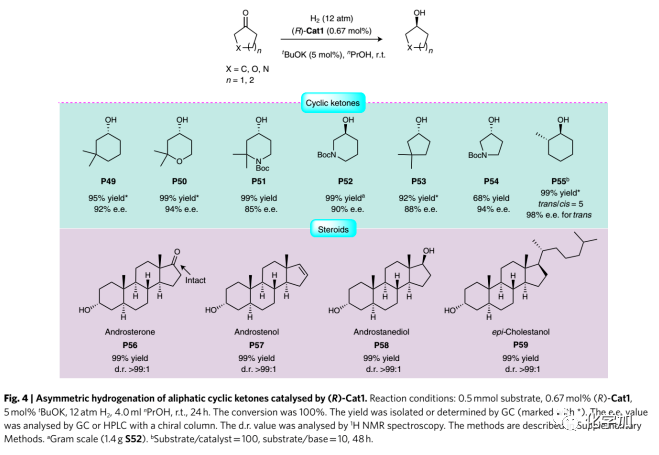
與烷基甲基酮一樣,脂肪族環酮也是進行不對稱氫化的挑戰性底物。由于手性環醇如3-羥基哌啶是許多藥物和天然產物的合成子,所以有必要開發這種酮的不對稱氫化方法。因此,作者嘗試通過(R)-Cat1催化劑將該方法用于各種脂肪族環酮(Fig. 4)。多種酮包括氮雜和氧代環酮均可以高收率和高對映選擇性進行氫化得到相應的環醇。在0.1 mol% (R)-Cat1存在下,N-Boc-3-氧代哌啶(S52)經氫化得到抗癌藥物(R)-ibrutinib的活性成分(S)-N-Boc-3-羥基哌啶(P52,99%收率,90% e.e.)。此外,前人報道的P52的合成涉及從手性原料開始的多步過程或酶促還原。另外,2-甲基環己酮的不對稱氫化經動力學拆分得到主產物反式-2-甲基環己醇(P55,98% e.e.,trans/cis=5:1)。作者還發現(R)-Cat1對甾體化合物S56-S59的氫化還原也顯示出優異的收率(99%)和非對映選擇性(d.r.>99:1)。
(圖片來源:Nature Catalysis)
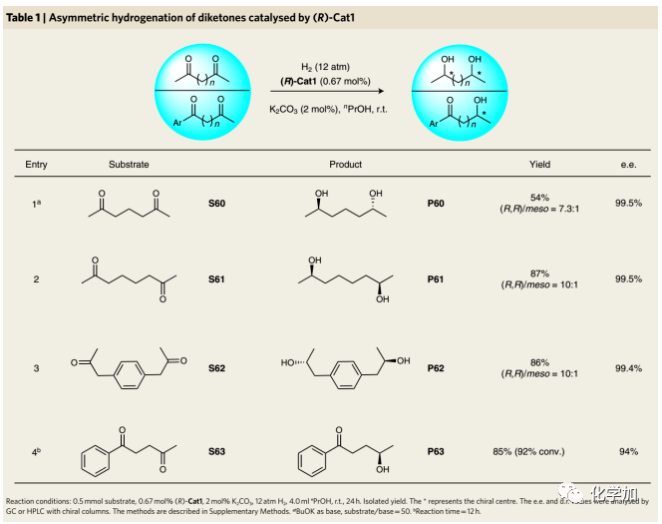
二酮的不對稱氫化:作者研究了幾種二酮的不對稱氫化以合成手性二醇(Table 1)。2,6-二庚酮(S60)通過(R)-Cat1催化加氫得到手性1,5-二醇P60(54%),具有優異的對映選擇性(99.5% e.e.)和良好的非對映選擇性((R, R)/meso=7.3:1)。S61和S62的氫化表現出更好的收率和非對映選擇性。在芳香酮存在下,(R)-Cat1選擇性催化氫化S63的脂肪酮,得到具有抗癌活性的酮醇P63。手性二醇是合成各種藥物和手性二膦配體的重要起始原料。例如,對映體純的P60可用于制備2,6-二取代的六元雜環,該雜環常見于許多藥物如吡美諾、氯帕胺和抗菌劑中。
(圖片來源:Nature Catalysis)
密度泛函理論(DFT)研究:為了解反應的對映選擇性機制,作者對(R)-Cat1-催化的2-丁酮的氫化進行了DFT研究。(R)-Cat1的球棒模型表明,P2原子上的3,5-二叔丁基苯基、P1原子上的3,5-二金剛烷基和配體的螺環骨架構成了一個深而狹窄的手性口袋(Fig. 5a)。由于其擁擠的手性環境,當底物靠近催化劑的活性中心時取向受限。R產物(TSR)的過渡態計算能量比S產物(TSS)的過渡態計算能量低1.7 kcal mol-1(Fig. 5b),這與反應形成R產物一致。此外,作者還利用象限模型解釋了2-丁酮的不對稱氫化中(R)-Cat1的對映體控制(Fig. 5c)。第II和III象限分別被含金剛烷基的芳基和催化劑的螺雙茚滿骨架所占據。第IV象限中的芳基與金剛烷基連接,使其比第I象限中的芳基(與叔丁基連接)更擁擠,導致底物以si面接近催化劑,有利于形成R產物。

(圖片來源:Nature Catalysis)
總結:南開大學周其林院士課題組通過合理設計具有狹窄且擁擠手性口袋的手性螺環銥催化劑實現了對二烷基酮的高度對映選擇性氫化。其中,手性配體的三齒螺環結構和龐大的膦基使催化劑具有顯著的穩定性和對映選擇性。該方法解決了催化不對稱氫化中的長期挑戰,在手性藥物和精細化學品的合成中具有廣泛的應用潛力。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn