- 首頁
- 資訊
清華羅三中課題組Angew. 電化學原位生成苯炔用于環狀β-酮羰基化合物的不對稱α-芳基化反應
來源:化學加編輯部 杉杉 2020-06-22
導讀:由于苯炔是高反應活性和非極性的中間體,基于苯炔中間體的不對稱催化是挑戰性難題。近日,清華大學羅三中教授課題組在Angew發表論文,報道了一種電化學氧化生成苯炔和環己炔中間體的方法,并成功與手性伯胺催化相結合,從而實現第一例催化不對稱烯胺-苯炔(環己炔)的偶聯反應。研究發現乙酸鈷可穩定原位生成的芳炔中間體并促進其與烯胺的偶聯。此外,該催化體系可用于構建具有季碳手性中心的α-芳基或環己烯衍生物。文章鏈接DOI:10.1002/anie.202006016
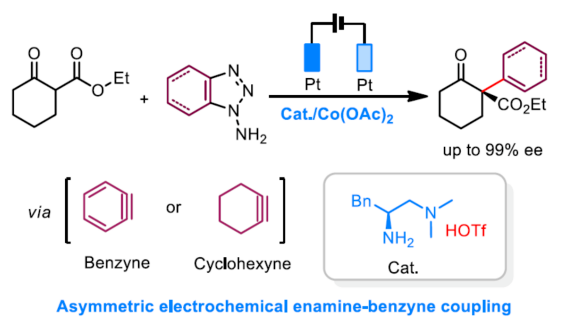
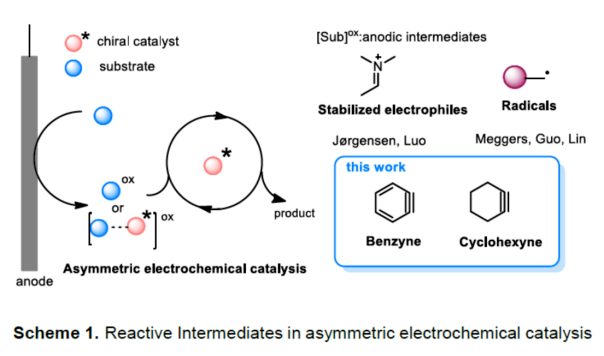
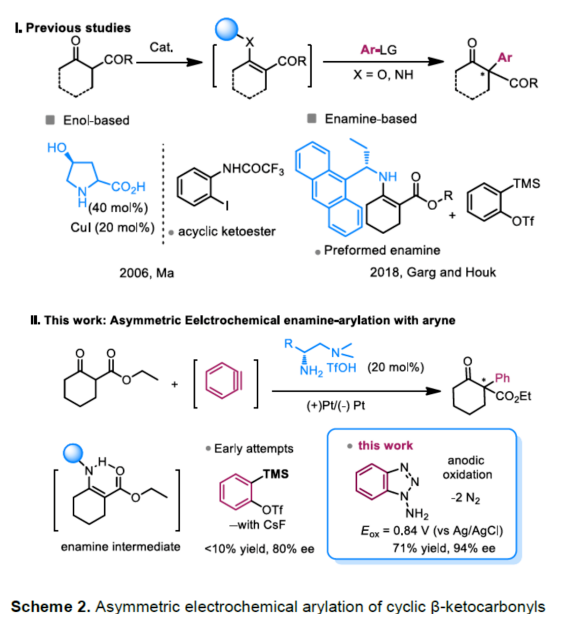
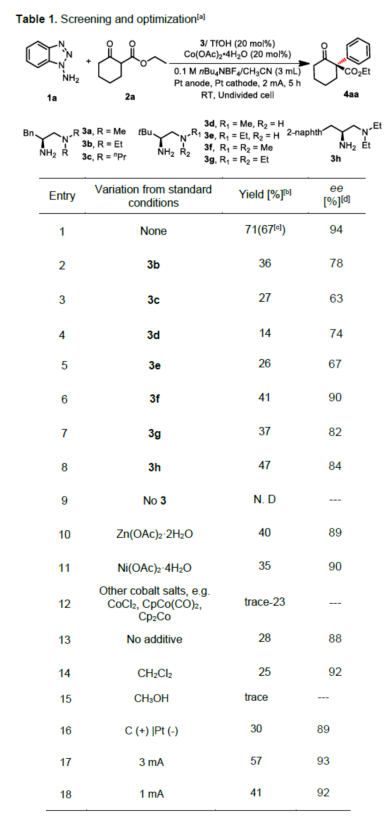
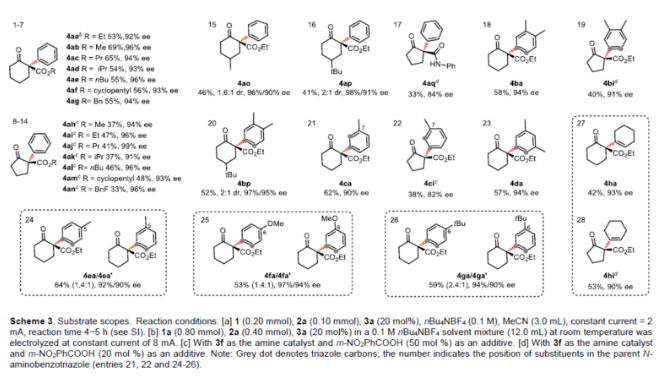
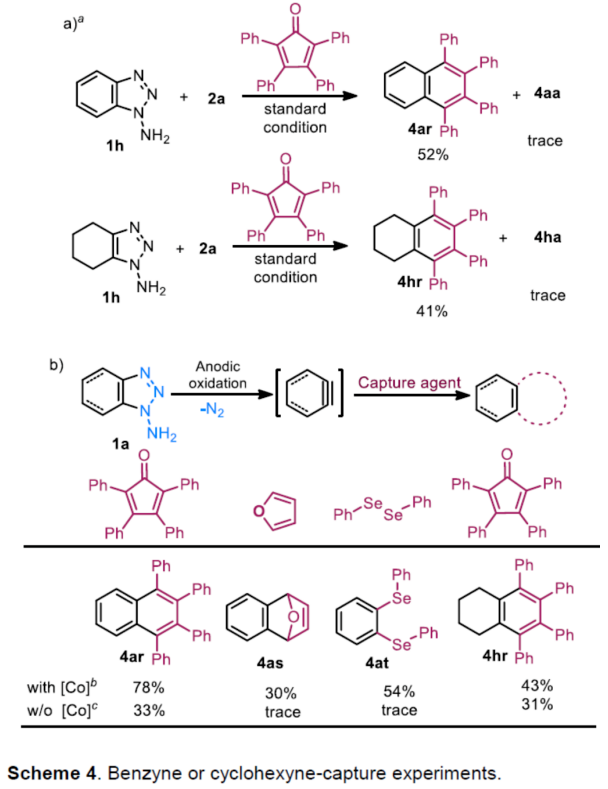
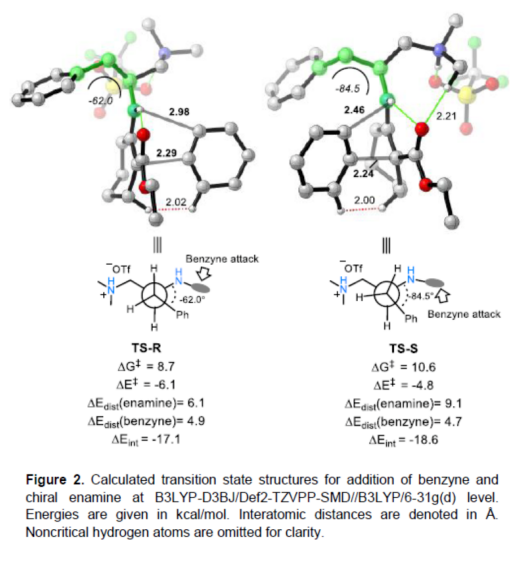
(圖片來源:Angew. Chem. Int. Ed.)早在1966年就有不對稱電化學催化相關的報道,然而由于不對稱催化的成功和近期光化學反應的突破進展,從而導致該領域的研究未被高度關注。同時,該領域主要的挑戰可能至少來自這樣一種先入為主的觀念,在電化學反應必不可少的導電介質中,可能對立體控制產生不利的影響。此外,不同于典型的溶液相不對稱催化反應,不對稱電催化存在非均相電子轉移過程。近年來,由于綠色化學和可持續發展的需求,不對稱電化學催化已成為研究的熱點(Scheme 1)。J?rgensen和羅三中等課題組報道了陽極氧化可用于不對稱氨基催化過程中,可生成穩定的親電體(如亞胺或亞胺陽離子中間體)。最近,Meggers、郭昌和林松課題組報道了通過陽極產生的自由基實現不對稱催化反應。盡管目前已取得一定的進展,但不對稱電化學催化的潛力仍未得到充分探索。在此,清華大學羅三中課題組報道了通過陽極氧化生成苯炔或環己炔中間體,隨后在手性伯胺催化下,即可實現不對稱芳基化反應。(圖片來源:Angew. Chem. Int. Ed.)苯炔很少用于不對稱催化反應中,因為這種中性和高反應性物質的猝滅通常是自發發生的,在大多數情況下超過任何明顯的外部控制。同時,苯炔的捕獲總是伴隨著不希望的鍵形成和斷裂,從而增加了立體控制的復雜性。因此,苯炔參與的不對稱反應極為罕見。最近,Garg和Houk報道通過預先制備的手性烯胺和苯炔實現不對稱偶聯反應(Scheme 2, I)。受此啟發,作者試圖使用手性伯胺催化劑,實現β-酮酯與苯炔的催化烯胺芳基化反應。此前馬大為課題組報道了唯一例β-酮酯的高對映選擇性的催化反應,即2-乙酸乙酰甲酯與2-碘代三氟乙酰苯胺的偶聯(Scheme 2, I)。作者使用手性伯胺催化劑,初步研究了環狀酮酸酯2a與經典的Kobayashi苯炔前體(2-(三甲基甲硅烷基)苯基三氟甲磺酸酯)的偶聯反應。盡管反應得到了的80%ee,但進一步優化條件,產率也從未超過10%(Scheme 2, II)。因此,作者嘗試了其他的苯炔前體以及由Campbell和Rees開發的1-氨基苯并三唑。這一前體可在氧化條件生成苯炔中間體,但通常需使用高毒性的Pb(OAc)4作為氧化劑,從而導致反應經濟性、可持續性、兼容性等問題。然而,電化學氧化可以解決這些問題。(圖片來源:Angew. Chem. Int. Ed.)首先,作者以1-氨基苯并三唑(1a)和2-環己酮甲酸酯(2a)作為模型底物,分別對手性伯胺催化劑、金屬添加劑、溶劑、電極材料、電流等條件進行了廣泛的篩選(Table 1)。篩選結果表明,當以手性伯胺3a作為催化劑,Pt作為陽極和陰極,nBu4NBF4作為電解質,在室溫下的無隔膜電解槽中反應,能以71%收率和94%ee得到預期產物4aa。(圖片來源:Angew. Chem. Int. Ed.)在獲得上述最佳反應條件之后,作者首先對β-酮羰基化合物的底物范圍進行了擴展(Scheme 3)。當2-環己酮甲酸酯中的酯被其它基團(如甲基、乙基、正丙基、異丙基、正丁基、環戊基和芐基酯基)取代時,均可獲得高收率和高對映選擇性的目標產物4aa-4ag。4-取代的2-環己酮甲酸酯,也可獲得不對稱芳基化產物4ao和4ap,雖然非對映選擇性較低,但兩種對映異構體均具有較高的對映選擇性。而以2-環戊酮甲酸酯作為底物時,同樣可以獲得相應的產物4ah-4an,此時手性伯胺催化劑3f給出了更好的對映選擇性,從而。此外,2-環戊酮甲酰胺也可獲得α-芳基化產物4aq。然而,使用非環狀的β-酮酸酯未能獲得所需的產物。隨后,作者研究了1-氨基苯并三唑不同位置取代基對反應的影響。對于對稱的二甲基取代苯炔(如鄰二甲基、間二甲基取代),均以良好的收率和高對映選擇性獲得預期產物4ba,4bi,4bp,4da。對于單取代苯炔,鄰甲基取代獲得具有高對映選擇性的產物4ca,4ci。此外,對于間甲基取代的苯炔(或芳烴),觀察到兩個區域異構體4ea和4ea’,但兩種區域異構體均具有高對映選擇性。同樣,使用甲氧基和叔丁基取代甲基時,也觀察到了類似的結果4fa(4fa’)和4ga(4ga’)。此外,使用環己炔時,同樣可以獲得具有良好立體選擇性的α-環己烯化產物4ha和4hi。 (圖片來源:Angew. Chem. Int. Ed.)為了探究原位生成的苯或環己炔中間體,作者在該催化反應中加入兩當量的四苯基環戊二烯酮(淬滅劑),分別以52%和41%的收率獲得相應的淬滅加合物(4ar和4hr)(Scheme 4, a),并且檢測到痕量的烯胺偶聯產物。這些結果表明,電化學可生成高反應性的苯炔或環己炔中間體。此外,在不存在乙酸鈷的情況下,在陽極條件下僅檢測到痕量的淬滅加合物(Scheme 4, b),而三唑底物1a被完全消耗,陽極上沉積了未知的棕色焦油物。相反,加入乙酸鈷可大大促進苯炔的淬滅,同時陽極沉積也減少。因此,根據鈷在炔烴活化和轉化中的催化能力,作者認為鈷可以與苯炔的三鍵結合,從而起到穩定苯炔中間體并增強其與烯胺中間體偶聯的作用。 (圖片來源:Angew. Chem. Int. Ed.)此外,作者也通過密度泛函理論(DFT)計算揭示了乙酸鈷對苯炔的穩定作用。計算結果表明,乙酸鈷與苯炔的結合自由能為-18.6 kcal/mol,乙酸鎳為-5.5 kcal/mol,而醋酸鋅為1.1 kcal/mol(Figure 1)。同時,該配位對烯胺中立體控制影響很小。因此,苯炔-鈷配合物可能是游離苯炔在陽極條件下捕集烯胺的“儲存庫”。(圖片來源:Angew. Chem. Int. Ed.)隨后,作者又通過DFT計算進一步闡明α-芳基化對映選擇性的起源(Figure 2)。TS-R和TS-S之間的計算能量差為1.9 kcal/mol,與2.1 kcal/mol的實驗值非常吻合,從而有利于R的選擇性。在這兩個過渡態中,烯胺N-H和羰基分子內H鍵被認為限制了構象靈活性,并且形變主要來自催化劑部分。在TS-R中,以綠色突出顯示的催化劑骨架的二面角(-62.0o),與起始烯胺中間體的二面角(-66.0o)相差不大。相比之下,不利的TS-S二面角為-84.5o,構象形變較大,以最小化苯炔的進攻的位阻效應影響。(圖片來源:Angew. Chem. Int. Ed.)總結:清華大學羅三中教授課題組報道了一種通過電化學陽極生成苯炔中間體的方法,并成功與手性伯胺催化相結合,實現了第一例催化不對稱烯胺-苯炔(環己炔)的偶聯反應。同時,乙酸鈷作為添加劑可以穩定原位生成的苯炔中間體,并促進其與手性烯胺中間體的偶聯。烯胺-苯炔偶聯可用于高立體選擇性的合成環狀β-酮羰基化合物的α-芳基化或α-環己烯基化衍生物。
撰稿人:杉杉
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn