


其中之一是蛋白質動力學。他借助鋰化學的熱力學原理,以光譜學研究蛋白質如何移動,不是折疊,而是如何移動。他研究當蛋白質移動時,它們是如何影響我們身體功能的。他是我們稱之為生物物理學科的領軍人物。
Floyd Romesberg踏足的第二個領域是抗生素。他對廣譜或窄譜抗生素概念非常有興趣,成功開發了兩種革蘭氏陰性效果的抗生素。今年52歲的他已經擁有兩家公司,其中一家已經上市,另一家公司剛完成一輪總額6500萬美元的投資。
在建立第三個項目的時候,他決定和上帝好好聊聊。所以他花了18年時間去研究核酸,上帝說人只能將ATCG作為DNA序列的密碼,他卻通過疏水作用力用其他分子改變了DNA在新生命體中的編碼方式。在第44期理解未來講座中,Floyd就和我們分享了他是如何和上帝溝通的。下面是Floyd的精彩演講《可儲存與檢索新增遺傳信息的半人工合成生命體》(部分文字有調整):
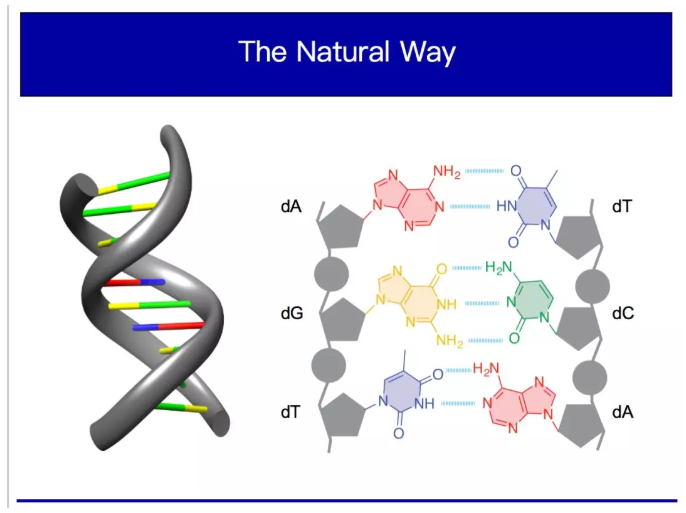
我實驗室做的工作是想看看能否可以自己不制造分子和替代品,而是讓人體自身的細胞為我們制造分子。分子是有可能會根據我們的需求定制的。因為生命由細胞構成,細胞都有細胞核,細胞核由染色體構成,染色體是DNA分子經過纏繞與蛋白質共同形成的。染色體的分子結構,也就是著名的DNA的雙螺旋結構。

DNA就是一個螺旋狀的生物大分子。我們人類的遺傳信息都儲存在DNA序列中,而DNA用ATCG四種堿基來編碼遺傳信息。這四種堿基相互之間有配對關系,A和T配對,C和G配對,經過配對之后就形成雙鏈結構,又因為化學穩定的傾向性,最終形成了雙螺旋結構,這就是DNA序列。這個序列有多長呢?有30億個堿基對,也就是30億個A-T、G-C字母對。不同的DNA區別僅在于字母的排列順序不同。
DNA是可以復制的。當細胞分裂的時候,細胞核也要分裂,基因組也會分裂,每次分裂之前它的DNA一定要復制一遍。怎樣復制?既然DNA通過ATCG四個字母來編碼遺傳信息,那誰來解碼呢?怎么解碼呢?
負責解碼的是RNA聚合酶,它是一個蛋白,在DNA上面可以把雙螺旋打開,像一只手一樣把雙鏈結構分開,分開之后單鏈就露出來了,然后RNA就會以單鏈序列為模板把信息抄寫到另一個分子——RNA分子上。RNA分子結構和DNA很像,也是四個堿基,即AUGC,A對U,G對C,也就是說能根據DNA的堿基配對,把DNA序列原封不動的拷貝到RNA分子上,這個過程叫做轉錄。
單鏈RNA分子形成以后,會被從細胞核運到細胞質里。之后更神奇了,有一個巨大的分子機器叫做核糖體,它就好像一個組裝機器的流水線,把RNA上面的四個字母以每三個字母搭配一種氨基酸(氨基酸是組成蛋白的基本材料,人體有20種常見的氨基酸)轉變為氨基酸序列,這個生產線過完之后就會形成一長串氨基酸鏈,這個鏈經過折疊后就變成了蛋白。不同的三個字母搭配不同的氨基酸會組成不同的蛋白,而蛋白是大多數生命的細胞里最重要的活性大分子。所以蛋白的組成在很大程度上的決定了你的細胞是什么樣子,每個物種是什么樣子。
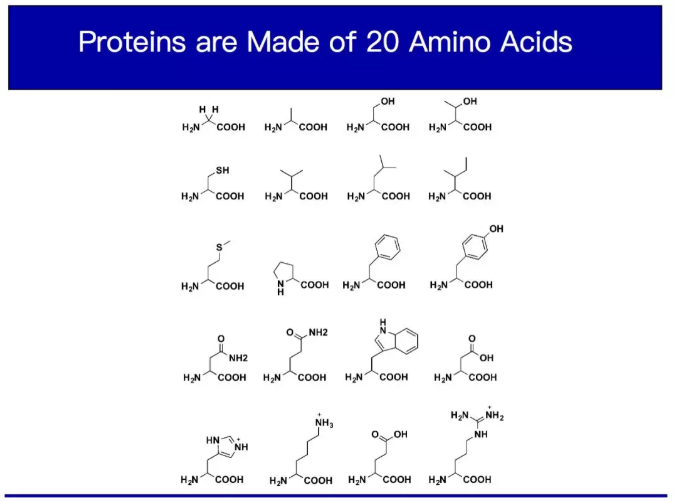
我和我的團隊感興趣的是如果超越四個堿基和雙鏈結構呢?能不能是五個或者六個字母呢?能不能是三鏈結構呢?那會生成什么樣的蛋白質呢?會產生什么樣的結果呢?在告訴大家方法論前,我先來講講我這樣做的動機。
動機分兩種,概念性動機和實用性動機。從有人以來,人們就開始思考,生命是什么?生命由什么組成?分子嗎?如果是,那是什么分子?對于這個問題,人們有不同的解讀。有人說生命和分子已經如此完美,它們是造物主存在的證據。上帝將生命注入物質,注入到分子中,這樣分子才得以在生命中發揮作用。有些人則和達爾文站在一起,認為生命是進化得來的。不過不論你同意哪種觀點,有一點是可以確定的,那就是自然造物已經如此完美,而經歷過數十億年的進化,大自然已經沒有多少空間留給化學家去造物了。那化學家還能做什么呢?
從實用角度看,從胰島素開始,蛋白質藥物已經顛覆了整個醫藥產業。如今蛋白質治療劑的種類越來越多,它做了很多小分子藥物做不了的事情。我們是不是可以這方面入手開發出新的蛋白或者蛋白藥物呢?
如果你對此感興趣,就必須設法做出我提到的第五個和第六個字母,這樣才可以在生物體中編碼出和常見的二十個氨基酸不一樣的氨基酸。自然系統的工作方法,正如我提到的G配對C、A配對T,它是通過共享氫原子來實現,科學家稱之為氫鍵。因此G具有粘附于C的氫鍵模式,A具有與T互補的氫鍵模式。現在,為了搭配出第五和第六個人工的字母對,來形成第三對人工堿基對,科學家借助了核苷酸。我們必須考慮應當嘗試利用什么樣的作用力。在自然界中有很多種作用力,我們不必非要使用自然界賴以用于信息和存儲和檢索的那個作用力。
事實上,有一種強大的作用力稱為疏水作用力。它被認為是控制早期蛋白質折疊過程的主要作用力。舉例說明,如果你把水和油混合起來,它們會互相逃避,不會混在一起。因此,如果我們制作疏水性的核苷酸類似物,像油一樣它們不會和類似水一樣的堿基配對,但它們可能會相互配對。所以我們可以使用這種作用力,因為它和大自然所用的作用力不一樣。那么我們是否可以利用疏水作用或其他堆積作用力來實現遺傳信息的穩定儲存和檢索呢?這就是最初的想法。所以我的實驗室開始沿著這個方向探索。我是個化學家,我們從藥物化學的角度思考問題。我們試著用化學藥物開發的方法制造類似物。

大家從下圖可以看到一部分堿基,它是雙鏈螺旋字母的一部分。你們可以看到結構,雙鏈之間的梯子,這些通常相是會互相作用的部分。里面還有一些額外的糖和形成寡核苷酸或DNA的磷酸鹽,這里就不詳細描述了。我們設計的所有類似物都是疏水性的,它們被設計成用疏水作用力彼此配對,而非互補氫鍵作用。然后我們開始嘗試制造這些類似物。

就像我上面說的,我們用的是藥物化學的方法。我們首先嘗試的是制作一些簡單的堿基對,把它們放入DNA,看看細胞中的DNA聚合酶在復制DNA信息的時候能否能識別它們,以此分析這些人造堿基對的能力。剛開始的時候,我們只能在試管里做實驗,因為早期的堿基表現欠佳。它們幾乎無法被DNA聚合酶識別。我們瞪大眼睛仔細看,但看不到任何被識別的跡象。后來我們發現了一些稍微活躍一點的堿基,我們把它們收集起來,仔細觀察它們有什么不同之處。據此我們開始混合、匹配并組合差異,提升它們的多樣性。這是醫藥化學研究化學藥物的方法。
他們建立了所謂的結構活性關系,以了解分子設計中的特定變化如何影響其行為。一旦構建這些關系,你就可以用這些關系設計其他類似物以繼續完成該過程。所以我們篩選了很多類似物。這些類似物,現在在實驗室中被稱為“第一代類似物”。你可以看到它們都相當的大,隨著我們越做越好,我們開始探索一些更小的(如下圖)。這些,現在在實驗室中被我們稱為“第二代類似物”。你看,我們正在探索很多不同類型的東西。我們正在研究不同的氟、處于不同位置的氟原子,或這種取代基,這是甲基中的氧或僅僅是簡單的甲基,許多不同大小的環。
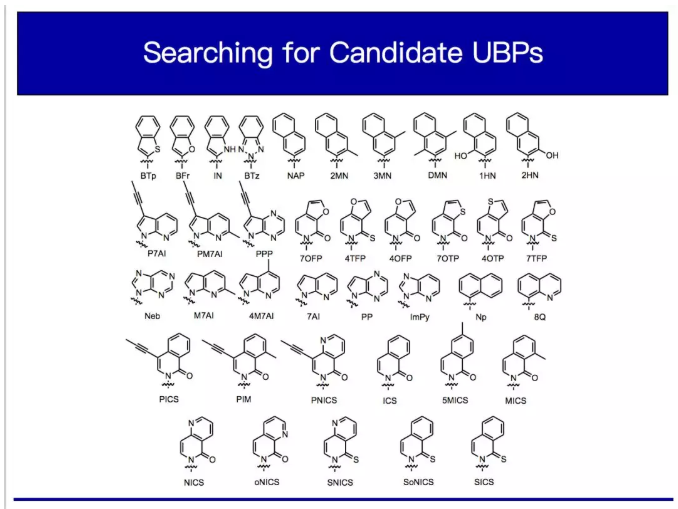
第一代類似物

第二代類似物
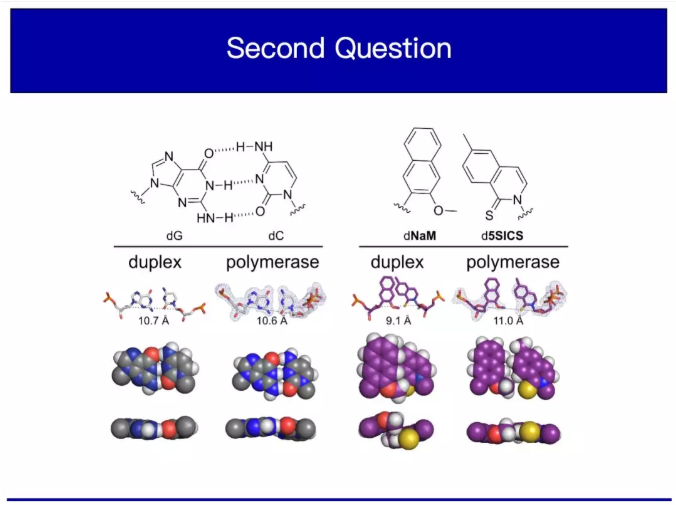
經過不停探索,大約14年后終于找到了一對,我們稱之為dNaM-dTPT3。我在這里展示它在DNA里的樣子,也正好可以再次向大家展示維持天然堿基對的氫鍵。
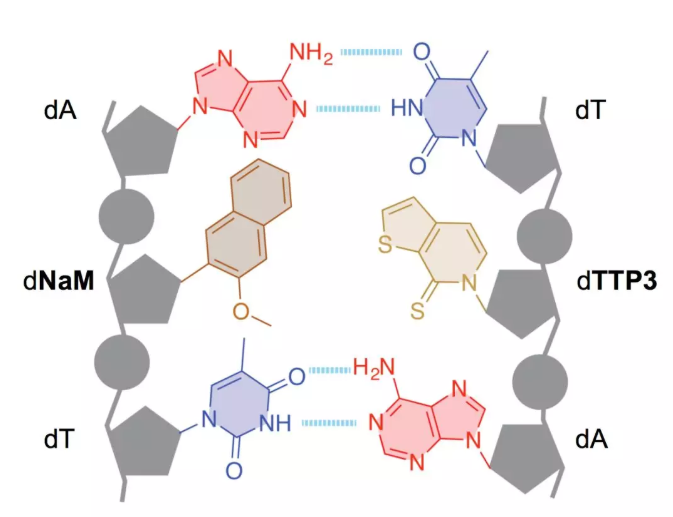
這是堿基A和T及令他們粘在一起形成雙鏈的互補氫鍵。如我所說,它也是能夠被復制和信息最終以蛋白質形式表達的能力基礎。這里有兩個A-T對。這是我們的堿基對(灰色部分)。我們的沒有額外的氫鍵,但它們卻能抱在一起。首先我認為這是一個非常有概念意義的結果。如果觀察自然形成的DNA雙鏈體,你會發現,那些互補的氫鍵是它們中最明顯的部分,并且每個人都認為它們是DNA必不可少的。而我們告訴大家,也許任何你可以駕馭的作用力,任何你作為化學家可以理解和研究的作用力,你都可以調配,并用來儲存和表達信息。所以我們開始重復利用這種疏水作用力。
我們很想在活體細胞內嘗試這一發現。但在此之前,我想先告訴大家一些關于我們研究機制的細節,因為我認為這個故事非常精彩,是我最喜歡的實驗室故事之一。開發出這些人工堿基對后,我們假設即使沒有氫鍵,它看起來也會很像天然堿基對。大家都認為聚合酶的能力是復制DNA序列信息然后將其轉移到蛋白質中。每個聚合酶會識別特定的天然堿基對,也就是GC或AT。事實上,這對堿基被稱為沃森-克里克堿基對。可能大家都聽說過,它是化學領域最著名的結構之一。因此,在圣地亞哥大學的最后階段,我們解出了雙鏈DNA中非天然堿基對的結構。下圖里有十個不同結構,這是十個不同結構的疊加,這里是平均結構。
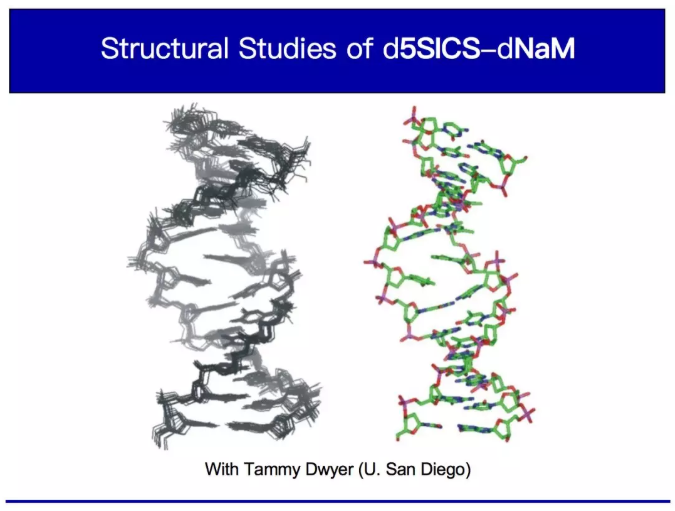
大家從上圖中可以看到,這些美麗的堿基對從上到下地排列在DNA里。中間這個是我們的,看起來不像天然堿基對。我把這個堿基放大,就是這個交互的部分允許它們配對。這是一個GC堿基對,G通過氫鍵和C配對。無論是CG還是GC,TA或AT都無關緊要。所有這些堿基對形成完全相同的結構。無論是在雙鏈DNA或者在合成堿基對的過程中,它們總是形成相同的結構。我們的人工堿基對的配對方式就完全不一樣。科學家稱之為嵌插作用。
讓我們用藥物研發的思維來看這個問題。假設你發現了一種可以殺死細菌的分子,然后你拿去找輝瑞或諾華,讓他們把它做成藥。他們會問你:“它的靶標是什么?作用機制是什么?”如果你的回答是:“誰在乎呢!我已經證明它有活性了。”那藥企什么支持都不會給你。因為醫藥研發花費巨大,藥物研發有嚴格流程,你想得到資金支持,必須弄明白你的分子的靶標和作用機制。
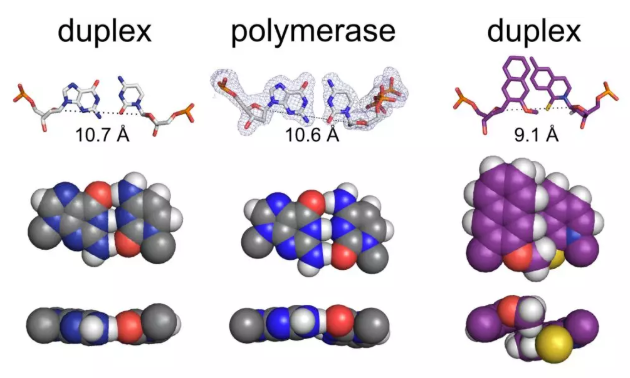
所以在這里概念是類似的。我們已知DNA聚合酶可識別看起來像這樣的東西,我們的小東西看起來不像這樣(如上圖)。事實上,我們的家伙看起來像一個大自然的錯配。眾所周知,DNA聚合酶已經進化為拒絕自然錯配,所以我們在這里必須做些偽裝。我們希望研究復制過程中的結構。我和康斯坦斯大學的朋友安迪·馬克斯(Andreas Marx)合作,我們得到了各種各樣的結構。
為了說明這一點,我必須先簡要地講講DNA聚合酶是如何工作的。它負責復制DNA。它看起來像一只右手。 在酶里面你正在復制的DNA模板就像這樣待在里面。當你把正確的單體加入到正在生長的DNA中的時,它會使酶的指狀結構域落在酶的手掌和拇指區域上,形成非常緊密的封閉復合物。它就像一個拳頭,有選擇地非常具體地識別我說的那些沃森-克里克堿基對。我們的任務是找到任何類似這樣的東西,這就要思考兩件事。
第一個是我們的堿基對的結構要足夠強大,以驅動聚合酶中同樣大的構象變化。
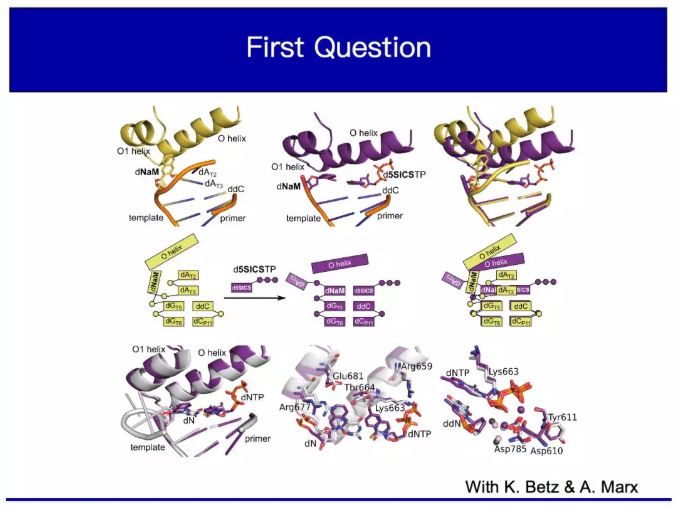
第二個是個問題,聚合酶到底在識別什么?如此緊密復雜的識別是什么?因為我們的堿基對看起來完全不像沃森-克里克堿基對,它看起來像是一個應該被拒絕的錯誤配對。我們和安迪一起開發了一些結構,我只會向大家展示一些重要的部分。這是二元復合物,二元意味著它由兩個部分組成。在這種情況下,它由正在合成的DNA和合成它的聚合酶組成。所以還沒有三磷酸鹽、也沒有單體被添加到正在增長的DNA中。這是我展示的唯一的聚合酶部分,它被稱為O和O 1螺旋,它是我提到的那個手指域的基礎。而這里是我們的小家伙從開發的螺旋中跳出來,無所適從。
現在這個是在科學中被稱為三元復合物的,因為它由三個部分組成,分別是:DNA模板、聚合酶和添加到DNA生長鏈中的單體。 可以看到我們的單體進入我們的人工堿基,你可以看到它去結合的模板現在已經轉變為正在發展的雙鏈體,進入不斷增長的DNA鏈。在聚合酶中也獲得了大的構象變化。這里是這個結構的輪廓,在這兒大家可以看到構象的變化。
現在為了說明它與由天然堿基對形成引起的構象變化完全相同,這里是三元結構,它正在合成我們的天然堿基對,另一個在合成GC堿基對。所以你看,它們的結構即使在側鏈的水平上也是絕對重疊,這一部分突出的蛋白質肉眼可見也是重疊的。甚至催化所需的水和催化相關的鎂離子也是重疊的。
所以非天然堿基對的形成驅動了從開放到閉合聚合酶復合物的幾乎相同構象變化。
現在我們來思考:它識別的到底是什么?
因為我們的配對并不像沃森-克里克堿基對。人工堿基確實形成了沃森-克里克形式的結構,但只發生在必要的在復制過程中。因此,科學家們討論出一種機制,通過該機制,天然堿基對合成為所謂的誘導契合機制。它的形成驅動了聚合酶的這種大的構象變化。人工的堿基對不會被各種各樣奇怪的機制復制,它只是通過相同機制的微妙變異來復制。它的結構驅動聚合酶的大的構象變化,但聚合酶的大的構象變化會驅動堿基對的相互構象變化。選擇疏水效應可能是我們最幸運的事,因為疏水效應很強,但它不是很有方向性,它能夠按照必要的方式移動。并且它足夠靈活,可以從聚合酶中獲取方向以形成正確的結構,這樣它就可以合成。
我們花了15年的時間優化這其中的化學合成工作。現在我們已經有了一個可以很好地復制的堿基對,可以被聚合酶很好地識別,我們可以用人工堿基對制造大量含有它的DNA,它們能非常好地保留高特異性和高效率。因此,我們有了向長期目標發起進攻的信心,我們已經掌握了讓其在鮮活組織中工作的系統能力,再回到開始的那個問題:我們能否靠擴展基因字母表,使活細胞、活生命體可以做更多事情?為了做到這一點,首先要思考的是我們要使用什么樣的生命體。我們選擇了大腸桿菌,因為操作大腸桿菌的工具最為先進。
我們面對的第一個挑戰是如何把我們的人造核苷酸的三磷酸鹽,也就是那兩個新的字母,放進細胞里?經過大約六個月的工作,我們注意到有一種不太相干的生物體,一種藻類,它利用核苷三磷酸轉運蛋白,在雙層脂質膜間運輸這些相同類型的單體。這種運輸工具的功能是將這些單體從膜的一側取出并傳遞到另一側。我們就想,如果把這些蛋白植入大腸桿菌,它們是否可以把我們的單體加入到細菌生長的培養基中,并把它們帶到細菌內部,這樣它就可以使用它們了。在這里我用這些小孔來顯示它們。
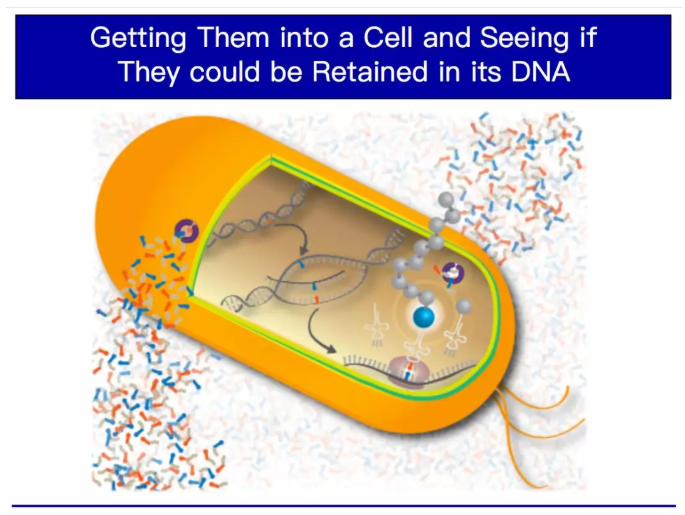
結果非常好,我們的起始材料得以進入活細胞。接下來的問題是:細胞會怎么對它們?如果我們給細胞一塊含有人造堿基對的DNA,它能復制并隨之生長嗎?我們花了14或15年的時間才做到這一點,而我已經準備好再花14到15年來讓它在大腸桿菌中工作。結果只用了大約三個星期。自從地球上所有生命的最后一個共同祖先以來,地球上所有生命一直用四個字母、兩對堿基對,每一個生物都是如此。而這些含有6個字母,即三對人工堿基的大腸桿菌細胞正在生長、分裂。這太令人興奮了!
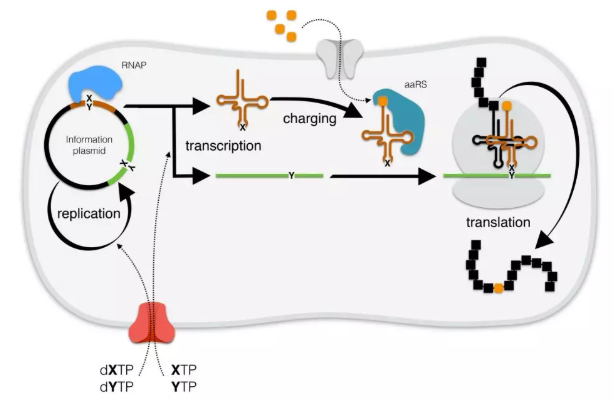
既然我們可以將DNA存儲在這些活細胞中,我們能使用它嗎?我們能讓這些細胞用超過20種簡單的氨基酸來制造蛋白質,或者用我們挑選出的氨基酸,以便能夠制造出更多樣化的蛋白質。所以我必須告訴你一些關于它工作方式的更多細節。
現在轉運蛋白dXTP和dYTP只是DNA復制的起始材料。XTP和YTP是你要生產的單體的起始材料,這些單體用于復制DNA。它們會被用于將DNA轉移到RNA中。你必須制作兩片RNA,一種代表信息的mRNA和一種代表轉移的tRNA。在這兩種分子起作用的方式是它們進入細胞的核糖體,mRNA排成列,mRNA具有編碼蛋白質的DNA序列,然后tRNA進入并引入氨基酸。在這種情況下,它會引入不同于普通天然氨基酸的人工氨基酸。而且我們不會用含有新序列中的人工堿基對來編碼人工氨基酸。所以我們就想看看我們是否能夠表達蛋白質。我們去年年底發表了一篇論文,闡明了我們能夠合成蛋白質。
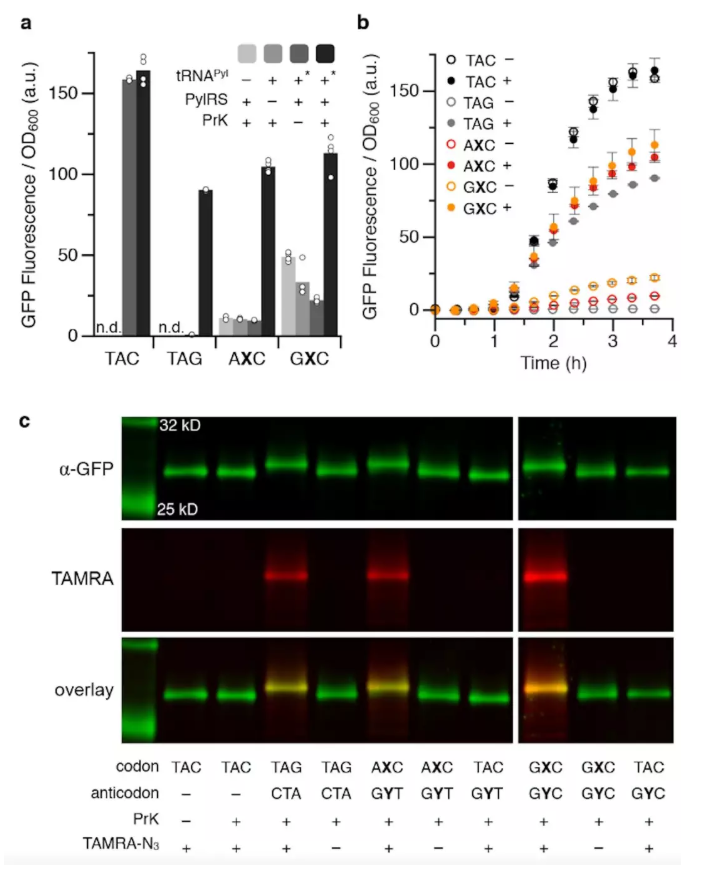
讓我簡要介紹一下細節。我在這里展示下蛋白質的產生,它恰好是一種熒光蛋白質,所以你可以看到熒光產生了多少蛋白質。這是一個自然的序列,我們在這里生產了幾種不同的蛋白質,它們的生產非常有效率。如果你不添加所有必要的成分,你得到的蛋白質會很少。這個凝膠很復雜,但是如果你集中在這最后一條通路,這就是如果你沒有所有必需品的情況,而如果你都有,那就會看到轉變。因此,我們加入的人工氨基酸有一個小標簽,可以讓我們在上面附加東西,這就是我們判斷人工氨基酸存在的辦法。在這種情況下,我們附著的是一個熒光基團,它只是一個發光的分子,所以它被叫做TAMRA。
所以當你附上它時,你會看到一條帶子。這就是所謂的電凝膠,一種電泳凝膠。你會看到蛋白質通過凝膠遷移并形成一條帶的過程。你看,這條帶子是紅色的因為它上面有熒光基團,就是說它含有人工氨基酸。你們看一下質譜數據就知道這個蛋白質純度非常高。這是一個自然控制,這是兩個自然控制,它們是非常純凈的,而這些是我們的。我們確實受到了一些污染。請注意,突破就在這里,所以這些是10%到90%,這是低到2%,立竿見影,我們的污染全部小于2%。這已經和通過其他方法引入人工氨基酸的標準一樣好了。這是一個小細節,但我想強調一下,因為它很重要。
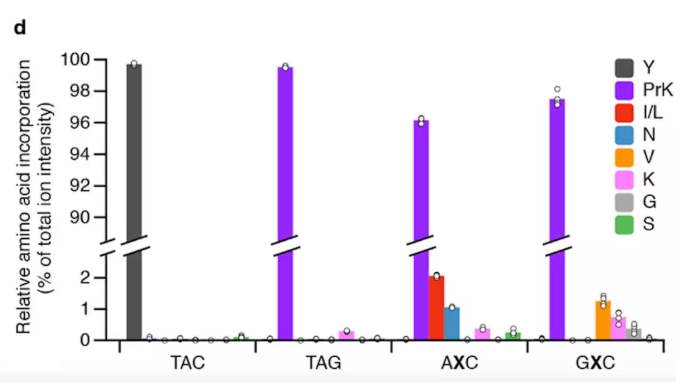
引入的人工氨基酸對應在復制過程中丟失的DNA序列。所以錯誤不是在蛋白質生產過程中出現的,而是DNA在保留人工堿基對時出現的,這確實是最困難的一步。我想說的重點是,我們已經在實驗室中開發了一種方法,可以提高保留率,將DNA的保真度提高幾個數量級。 它們沒有出現在這里,因為在這些早期的研究中,我們想要表明的是,如果不使用自然編碼所用的單一氫鍵作用,我們也可以使用完全不同的作用力來編碼信息。因此,不僅我們的字母是新的,而且它們配對的方式、它們使用作用力的方式,都與自然完全不同。
這回到了我之前提到過的關于生命分子的概念問題:生命的分子有多特別?他們有什么特權?這些數據表明也許生命的分子并不那么特別,也許化學家可以理解和培養的許多不同種類的分子、不同的作用力,都是合適的。
我們成立了一家生物技術公司,該公司正將這個技術商業化,生產用于治療特定疾病的蛋白質。這是我演講想展示的最后一個部分。我們稱之為SSO,即半合成生命體(semi-synthetic organism)。這是他們成長和分裂的實際情況。自從最后一個共同的祖先以來,地球上的所有生命都被四個字母、兩對堿基對、以及20個天然氨基酸編碼而成。而這些正在成長的細胞是有著六個字母、三個堿基對,以及它們在這種情況下是用21個氨基酸來制造蛋白質。

我的演講就到這里,謝謝大家。
本文經公眾號“未來論壇(ID:futureforum)”授權轉載
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn