


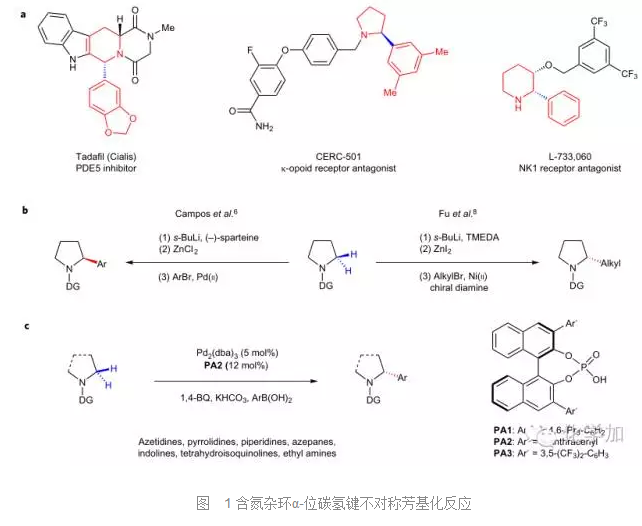
含氮雜環是天然產物及藥物分子中的重要結構單元,如圖1a所示,這些重要的藥物分子中都包含了含氮雜環,其中氮原子的α-位取代基對于活性具有重要影響,因此氮原子的α-位碳氫鍵的不對稱官能團化反應就顯得非常重要。之前,已經有通過酰胺導向鄰位鋰化、轉金屬化進而在過渡金屬(Pd或者Ni)催化下與親電試劑反應的策略來實現四氫吡咯衍生物α-位碳氫鍵官能團化的報道(圖1b),但這種策略只局限于四氫吡咯環α-位碳氫鍵的活化,對于其它雜環則不太適用。而且強堿仲丁基鋰的使用,使得該反應的官能團兼容性變差。因此發展高效的普適性的胺類α-位碳氫鍵不對稱官能團化反應就顯得非常必要。近期,Scripps研究所的華人科學家、碳氫鍵活化領域大牛余金權教授就在Nature Chemistry上報道了他們課題組在手性磷酸作配體、鈀催化硫代酰胺導向的胺類α-位碳氫鍵不對稱芳基化反應的新進展(圖1c)。
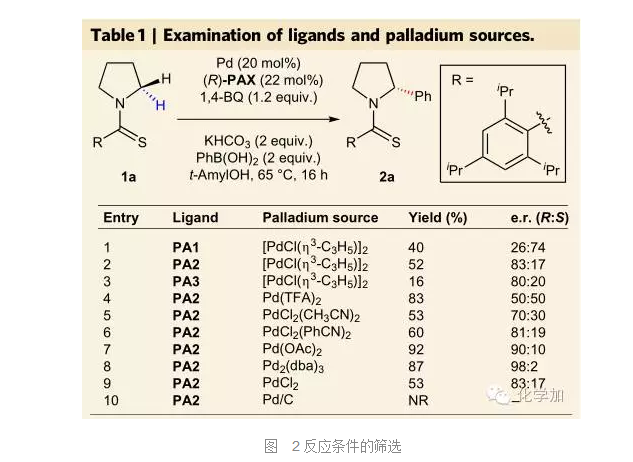
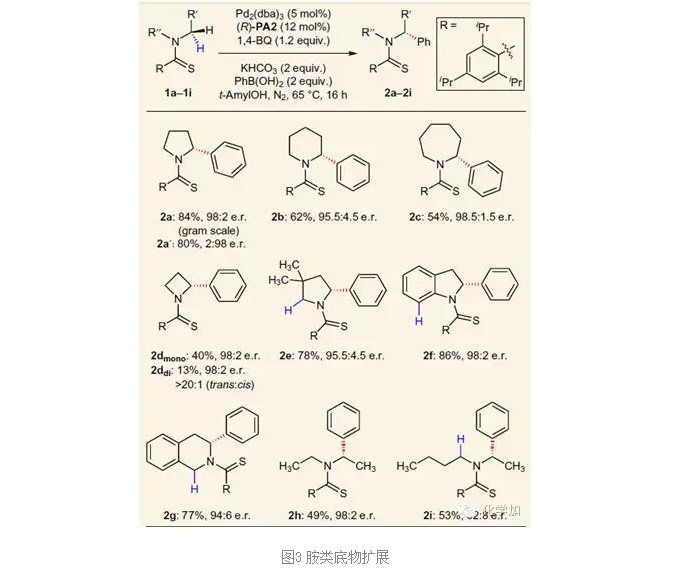
如圖2所示,在前期工作的基礎上,作者以硫代酰胺和苯硼酸的反應為標準反應首先進行了反應條件的篩選,通過條件的篩選,作者發現Pd2(dba)3作催化劑,(R)-PA2作配體可以取得最佳結果(entry 8)。 在使用Pd2(dba)3作催化劑,(R)-PA2作配體,1,4-BQ作氧化劑,KHCO3作堿的最佳條件下,作者對底物適用范圍進行了擴展,實驗發現,含氮雜環如4、5、6、7元環底物都可以獲得良好的產率和對映選擇性,除環狀底物外,鏈狀的烷基胺也可以取得良好的er值(2h-2i),但產率有所降低。
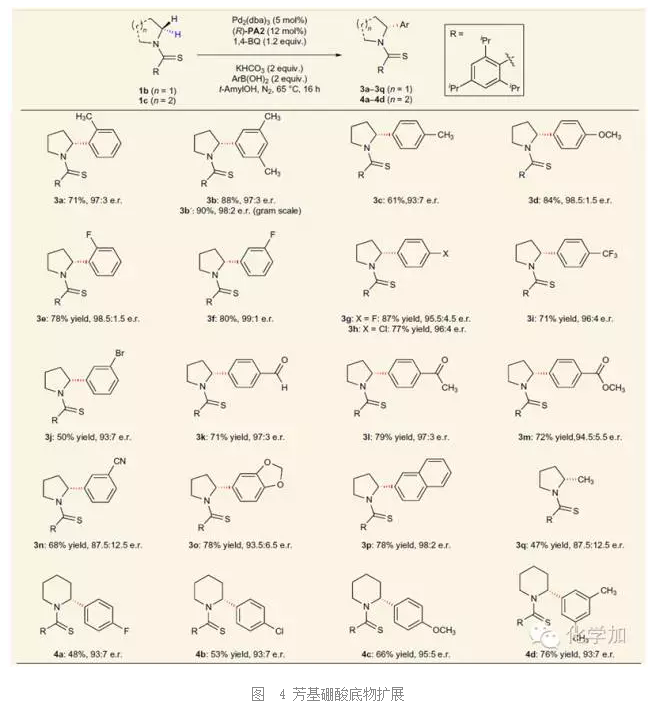
隨后,作者對芳基硼酸類也進行了擴展,如圖所示,不同位置或者不同電性取代的芳基硼酸與四氫吡咯或六氫吡啶類底物都可以獲得良好到優秀的結果,芳基上的取代基如烷基、烷氧基、鹵素、氰基、醛基、酯基、縮醛等都可以兼容。
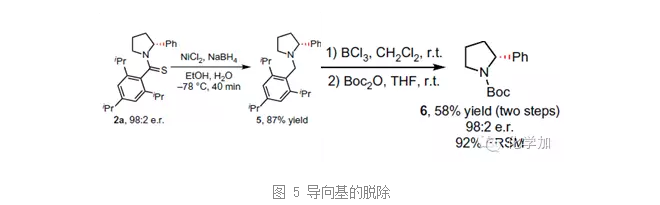
作者還通過一步NiCl2/NaBH4條件下的還原反應脫去硫羰基,BCl3脫去芐基保護基,就能順利地脫去導向基,得到α-位芳基化的四氫吡咯衍生物,整個反應過程中手性可以得到保持。
余金權課題組通過對不對稱碳氫鍵活化的深刻理解和長期的研究積累,這次利用手性磷酸作配體,在鈀催化條件下實現了硫代酰胺導向的胺類α-位碳氫鍵不對稱芳基化反應,該反應底物適用范圍廣泛,條件較為溫和,具有重要的應用價值。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn