


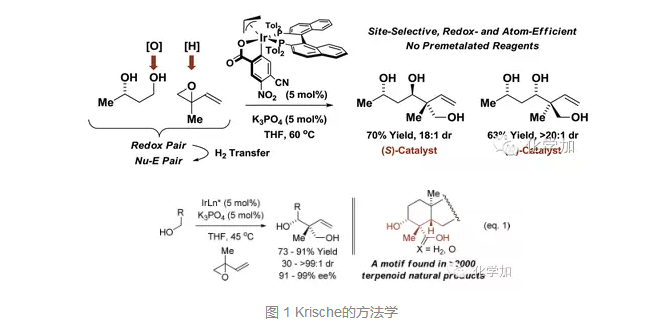
萜類天然產物是一大類次級代謝產物,已廣泛用于人類的醫療、農業以及香料工業等領域。萜類的生源合成和新的化學合成在很大程度上都依賴于多烯的串聯環化反應,但這一策略在化學合成上比較線性,相比匯聚式合成缺乏收斂,具有一定的局限性。近期,Krische課題組發展了新的方法學,通過對一級醇的碳氫鍵直接官能團化,實現了和異戊烯基環氧化合物的偶聯形成了新的碳碳鍵,并且以很好的非對映選擇性和對映選擇性構建了連續的兩個手性中心,其中一個是季碳中心,而這一骨架存在于2000多個萜類天然產物中。
Krische課題組便把這一方法學用于了幾個著名萜類天然產物Oridamycin A, Triptoquinones B 和 C以及 Isoiresin的全合成中,這幾個分子都曾備受有機合成化學家的關注,上海有機所的李昂研究員也曾報道過相關的全合成。
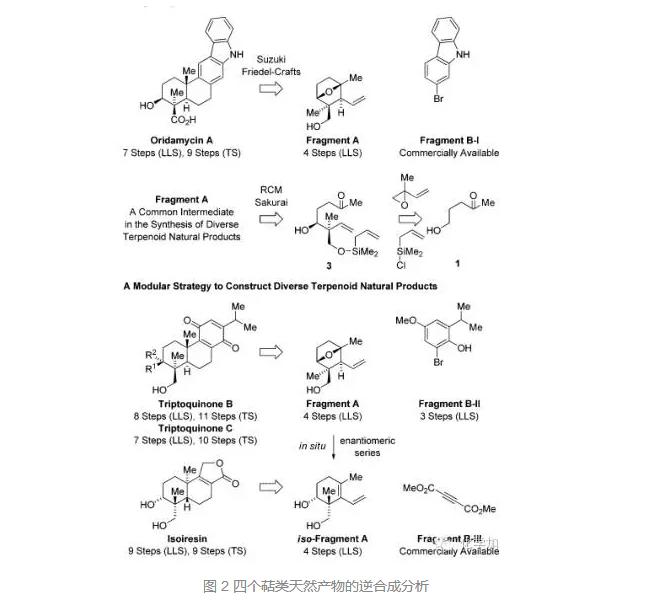
他們的逆合成分析如下:對于Oridamycin A,可以由片段A和片段B-I經由Suzuki偶聯反應和傅克反應合成,而片段A正是這幾個萜類天然產物的共同中間體,可以由化合物3經RCM反應合成,3可以逆推至簡單化合物。對于Triptoquinones B 和 C,由片段A和片段B-II合成,對于Isoiresin,可以由片段A的變體和片段B-III合成,這樣從共同的片段A出發,就可以實現四個天然產物的模塊化合成。
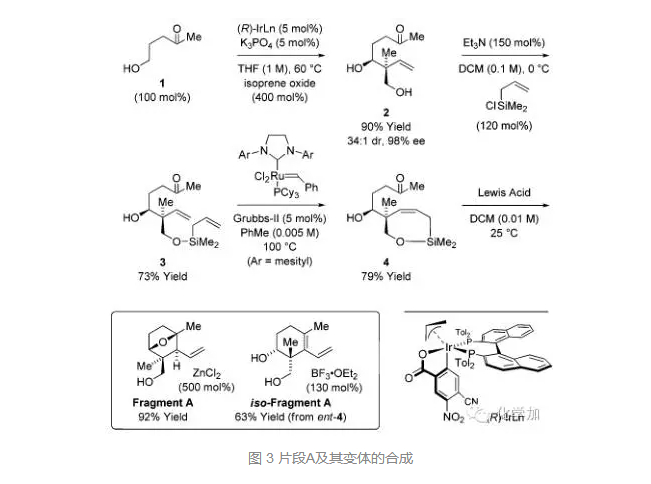
具體合成路線如下:化合物1和異戊烯環氧化物在銥催化劑的作用下以優秀的產率和選擇性得到化合物2,一級羥基在堿性條件下接上硅基鏈,得到化合物3,RCM反應得到化合物4,再在不同Lewis酸的條件下發生Sakurai反應分別以92%的產率得到片段A,以63%的收率得到A的變體。
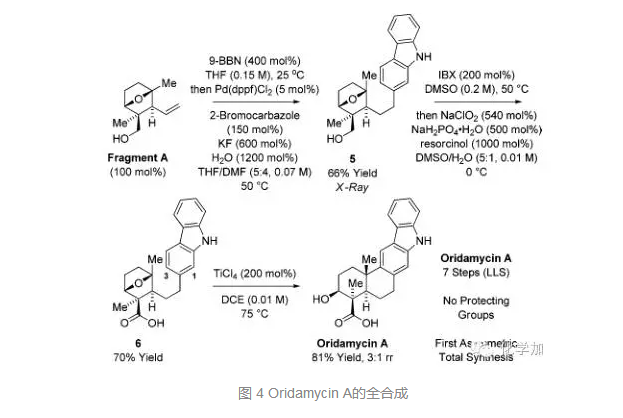
從片段A出發,雙鍵硼氫化后和2-溴咔唑發生Suzuki偶聯得到化合物5,并由單晶確定其結構和立體化學,氧化一級羥基到醛再發生Pinnick氧化得到羧酸6,最后在TiCl4的條件下發生傅克反應得到天然產物Oridamycin A,總共7步,無保護基,這也是Oridamycin A的首例不對稱全合成。
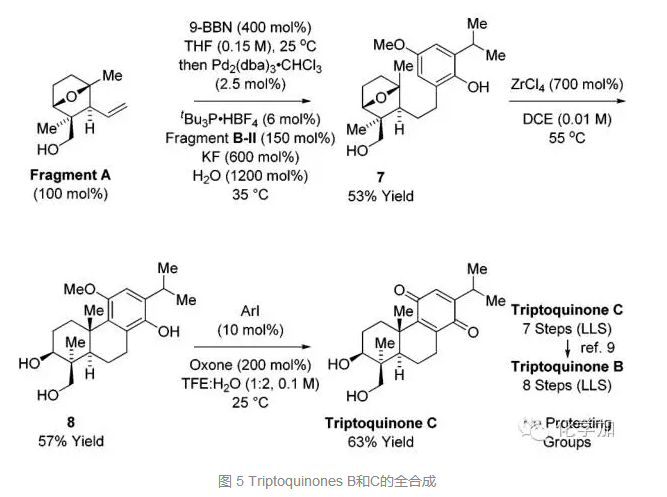
片段A硼氫化后和片段B-II發生Suzuki偶聯反應得到化合物7,傅克反應后得到化合物8,Oxone將其氧化為對苯二醌結構,就完成了Triptoquinones C的合成,再按照之前文獻報道的方法:在NaOCl和HOAc的條件下選擇性把二級羥基氧化為酮羰基,就可以完成Triptoquinones B的全合成,分別為7步和8步,也沒有使用保護基。
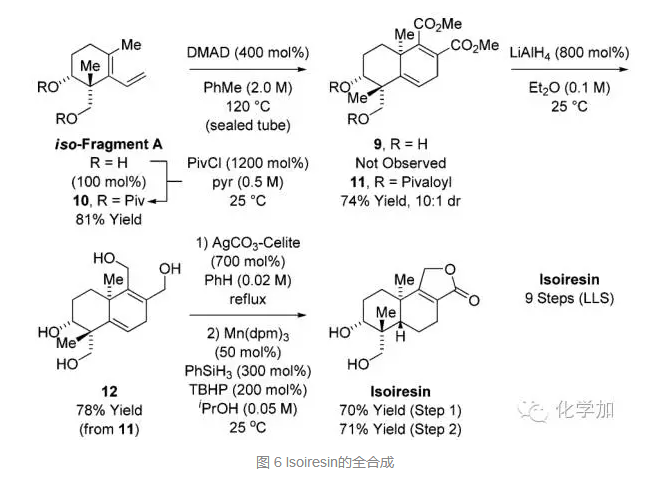
從片段A的變體出發,先對兩個羥基進行Piv保護,再和丁炔酸二甲酯在加熱的條件下發生分子間DA反應得到化合物11,而羥基不保護時得不到DA產物。從化合物11出發,LiAlH4還原兩個酯基,并脫去Piv保護得到化合物12,AgCO3氧化并選擇性氫化三取代雙鍵得到化合物Isoiresin,總共9步。
總結
Michael J. Krische課題組采用自己發展的方法學——催化不對稱地構建季碳手性中心,簡捷高效地合成共同中間體,并將其用于四個萜類天然產物Oridamycin A, Triptoquinones B 和 C以及 Isoiresin的模塊化合成,非常簡捷高效,符合原子經濟性和步驟經濟性的要求。這一重要方法學以及模塊化合成的策略對于萜類天然產物的合成具有重要的借鑒意義。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn